Prof. Blumes Bildungsserver für Chemie
Tipp des Monats Mai 2022 (Tipp-Nr. 299)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Fraktale Elektrochemie: Das Kupferbäumchen
Uwe Lüttgens
Gerne führe ich in mit meinen Chemiekursen einen einfachen Versuch durch, wenn es um das Themenfeld Elektrochemie geht: Das „Kupferbäumchen“. Dessen Wachstum und die Ästhetik der langsam vor ihren Augen entstehenden fraktalen Struktur fasziniert die Schülerinnen und Schüler immer wieder aufs Neue. Klick mich an! Bild 1: Ein Kupferbäumchen fasziniert durch seine feine Struktur
Dieser einfache elektrochemische Versuch ist rasch durchgeführt sowohl als Schülerversuch als auch als Lehrerdemonstration. Bei letzterem sollte allerdings das Wachstum mit einem Overhead-Projektor für alle gut sichtbar an die Wand projiziert werden. Vergleichbar mit dem hier beschriebenen „Bäumchen“ aus Kupfer [vgl. 1a] ist das „Silberbäumchen“, dessen Durchführung in [1b] beschrieben wird. Versuch: Kupfermännchen Geräte und Chemikalien: Petrischale, Rundfilter, abisolierter Kupferdraht aus Elektrokabel (∅ 2,52), 9V Block oder Kleinspannungsquelle, 2 Kabel mit Krokodilklemmen, Kupfer(II)-sulfatlösung (c = 1 mol/l). Durchführung: In eine mit Filterpapier ausgelegte Petrischale wird entlang des Randes ein zu einer ringförmigen Elektrode (Pluspol) gebogenes Stück Kupferdraht gelegt. Ein zweites Stück Kupferdraht dient, mittig auf das Filterpapier positioniert, als zweite Elektrode (Minuspol). Nun wird die Petrischale bis zur vollständigen Bedeckung der Ringelektrode mit der Kupfersulfat-Lösung befüllt. Mit einer Spannung von ca. 9 – 10 Volt kann ca. 20 min und 30 min elektrolysiert werden. Hinweise: Etwas Geschick ist beim Biegen der Ringelektrode notwendig. Diese lässt sich, einmal fertiggestellt, mehrfach einsetzen. Beendet werden sollte die Elektrolyse, bevor das „Kupferbäumchen“ die Ringelektrode berührt. Die fraktale Struktur kann mit dem Filterpapier aus der Petrischale herausgenommen und getrocknet werden. Bild 2: Der Versuchsaufbau
Ergebnis: Durch die Elektrolyse scheidet sich an der Kathode (Minuspol) elementares Kupfer als fein verzweigtes „Bäumchen“ ab. Bild 3: Wachstum des Kupferbäumchens während der Elektrolyse. Das „Kupferbäumchen“ wächst während der Elektrolyse vom Minuspol hin zum ringförmigen Pluspol. Nach 5 min (Bild 1) erkennt man im Ansatz die spätere Struktur. Nach 25 min (Bild 4) haben wir ein prächtiges Bäumchen.
(Foto: Lüttgens)

(Foto: Lüttgens)
(Fotos: Lüttgens)
Gehen wir dem „Kupferbäumchen“ ein wenig auf den chemischen Grund
Wir haben zum einen elementares Kupfer Cu(s) an den Elektroden. Zum anderen befinden sich hydratisierte Kupfer(II)-Ionen, kurz: Cu2+(aq.), und als Gegenionen die Sulfat-Ionen SO42-(aq.) der blauen Kupfersulfatlösung. Welche Reaktionen laufen nun bei der Elektrolyse ab? Da wir die Ringelektrode als Pluspol geschaltet haben, läuft dort die Oxidation des Kupfers ab. An der zentral angebrachten Elektrode findet die Reduktion der Kupfer-Ionen zurück zu elementarem Kupfer statt.
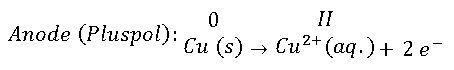
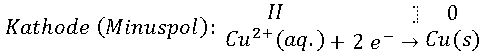
Auch wenn in den Teilgleichungen die Oxidation und die Reduktion einfach zu erkennen sind, kann uns die Änderung der jeweiligen Oxidationszahlen – das sind die römischen Ziffern II und die Zahl 0 über dem Elementsymbol Cu – bei der Zuordnung der ablaufenden Redox-Reaktionen hilfreich sein.
In der Elektrolyt-Lösung wandern während der Elektrolyse die positiv geladenen Kupfer-Kationen aufgrund ihrer Ladung in Richtung Minuspol, die Sulfat-Anionen in die umgekehrte Richtung zum Pluspol.
Übrigens: Die auffällig dunklere Färbung des an der Luft getrockneten Bäumchens im Bild 1 wird im Vergleich zum leuchtenden Rot des frisch aus der Elektrolyt-Lösung gefällten Kupfers durch eine teilweise Oxidation zu Kupfer(I)oxid erzeugt.
Vergleich zwischen der Struktur eines Baumes und dem „Kupferbäumchen“

Bild 4: Ein Baum hat eine fraktale Struktur.
(Foto: Lüttgens)
Betrachten wir einen Baum genauer und verfolgen den Weg vom Stamm über größere Äste hin zu den kleineren Ästen bis zu kleinsten Zweigen. Wir erkennen, dass sich der „Bauplan“ des Baumes mehrfach wiederholt: Der Ast sieht einem Baum ähnlich, der Zweig wiederum sieht dem Ast auch ähnlich. Und der kleinste Zweig scheint eine Art Kopie der vorherigen Strukturen zu sein. Ein Baum bildet sogenannte selbstähnliche Strukturen, die auch als Fraktale bezeichnet werden. Dieses Wort stammt vom Lateinischen Fractus und heißt so viel wie Bruch oder gebrochen. Dieses Erscheinungsbild mit den komplexen Verästelungen wird zum einen durch sein genetisch festgelegtes Wachstumsprogramm und zum anderen durch die jeweils speziellen Umwelteinflüsse seines Standortes wie beispielsweise die Bodenbeschaffenheit und die Wasserzufuhr sowie Wind und Wetter bestimmt.
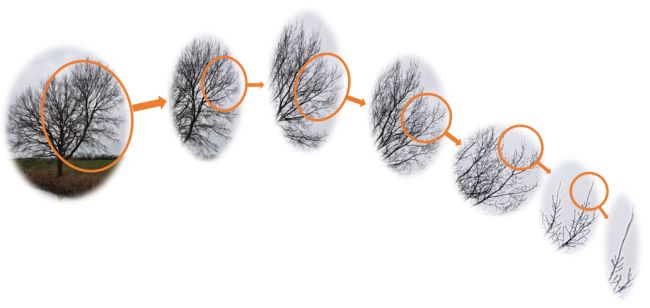
Bild 5: Von einem Baumstamm zweigen Äste ab, die sich in sechs Stufen immer feiner verzweigen. Alle Stufen vom Baum zu den Ästen und kleinen Zweigen sind sich selbstähnlich.
(Foto: Lüttgens)
Wenn wir mit offenen Augen in der Natur unterwegs sind, können wir zahlreiche fraktale Strukturen entdecken, bei denen sich der „Bauplan“ des Großen im Kleinen wiederfindet. Schauen Sie sich einen Farn am Wegesrand an - oder auch einen Blumenkohl oder Broccoli, wenn Sie das nächste Mal kochen. Ebenso zeigen die Wolken am Himmel, eine Bergkulisse, der Verlauf einer Meeresküste oder eines Flusses bei genauerem Hinschauen faszinierende fraktale, sich wiederholende selbstähnliche Strukturen, bei denen jeweils kleinere Abschnitte wie Kopien eines größeren Abschnitts erscheinen. Auch winterliche Schneeflocken oder Korallen im Meer sind Beispiele für solche Fraktale. Das bekannteste mathematische Fraktal ist die sogenannte Mandelbrot-Menge, ein Fraktal, gebildet nach einer Rechenvorschrift für komplexe Zahlen, das wegen seines Aussehens liebevoll als Apfelmännchen bezeichnet wird.
Zurück zu unserem Kupferbäumchen: Schauen wir uns dort die sich selbst wiederholende Struktur an. Sie ist jeweils keine perfekte Kopie der vorhergehenden, jedoch ist die „Mutterstruktur“ deutlich in den kleinen Verästelungen erkennbar. Mit mittlerweile geschultem Blick erkennen wir die Selbstähnlichkeit dieser Strukturen über fünf bis sechs Stufen hinweg – genauso wie beim oben abgebildeten Baum.

Bild 6: Das Kupferbäumchen - eine fraktale Struktur über fünf Stufen: Alle Ausschnitte sind sich selbstähnlich.
(Fotos: Lüttgens)
Für Spezialisten: Das Wachstum des „Kupferbäumchens“ – Ergebnis verschiedener Einflüsse
Zuerst klären wir, was die Bildung dieser fraktalen elektrochemischen Struktur an der Kathode bestimmt: Damit sich die positiv geladenen Kupfer-Kationen überhaupt auf der Kupferoberfläche ablagern können, muss deren Konzentration hoch genug sein. Denn nur dann reicht die Spannungsdifferenz zwischen der Elektrolyt-Lösung und der Metalloberfläche zur Abscheidung aus. Wer mehr über die Berechnung solcher Redoxpotentiale wissen möchte, kann sich hier über die Nernstsche Gleichung informieren.
Betrachten wir, wie sich die Teilchen in der Lösung bewegen und was an der Grenzfläche zwischen dem Metall und der Elektrolyt-Lösung genau passiert: Wie bereits gesagt wandern die hydratisierten Kupferionen in der Elektrolyt-Lösung entlang des elektrischen Potentials in Richtung der negativ geladenen Kathode. Im Falle einer solchen Bewegung, bei der die Richtung vorgegeben ist, spricht man von Konvektion. Der Begriff stammt vom lateinischen Verb convehere und heißt so viel wie zusammenbringen oder einbringen. Sicherlich wird diese gerichtete Ionenbewegung von der an die Elektroden angelegten Spannung und der Konzentration der Kupferionen in der Elektrolyt-Lösung abhängen. Natürlich gibt es auch zufällige Zusammenstöße der verschiedenen Teilchen in der Salzlösung, der Kationen und der Anionen sowie der Wassermoleküle. Dieser Vorgang wird als Diffusion bezeichnet (vom lateinischen Verb diffundere für ausschütten oder ausbreiten).
Spannend wird es, ein hydratisiertes Kupferion zu verfolgen, wenn es sich der Oberfläche der Elektrode in der Mitte unseres Versuchsaufbaus aus elementarem Kupfer annähert. Nun kommen „regionale“ Unterschiede an dieser Oberfläche ins Spiel; das sind kleinste Unebenheiten dort, wo die Oberfläche nicht perfekt glatt, sondern ein wenig rau ist. Denn dort stehen aus der ebenen Oberfläche des Kristallgitters aus Kupferatomen an den Ecken und Kanten einzelne Atome wie kleine Splitter aus einer glatt geschmirgelten Holzfläche heraus. An solchen Spitzen ist die Stärke des elektrischen Feldes und damit die Anziehungskraft für herannahende Ionen am größten. Physikalisch ausgedrückt: Je kleiner der Krümmungsradius ist, desto größer ist dort die Ladungsdichte des elektrischen Feldes. Solche bevorzugten Regionen auf der Metalloberfläche bilden die Keime, zu denen die Kupfer-Ionen sich hingezogen fühlen, um als elementare Kupferatome abgeschieden zu werden.
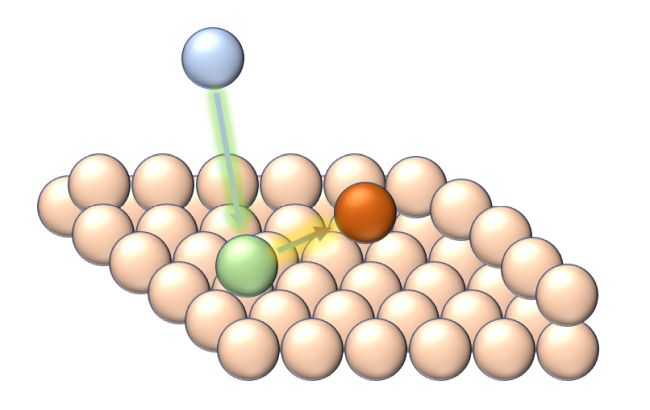
Bild 7: Die Abscheidung von Kupfer im Modell: Ein Kupferion (blau) lagert sich als Ad-Atom (grün) auf der Kupferoberfläche an. Anschließend wird es an einer Ecke oder Kante in das Gitter als Gitteratom (kupferrot), wobei die Valenzelektronen in das in das Elektronengas des Metallgitters aufgenommen werden.
(Skizze: Lüttgens)
Untersucht man diesen Vorgang genauer – dafür gibt es z.B. sogenannte Tunnelmikroskope, großartige „Lupen“, die findige Physikochemiker entwickelt haben, um einzelne Atome auf Metalloberflächen zu beobachten –, dann stellt man fest, dass dieser Vorgang noch ein wenig komplizierter ist und schrittweise verläuft. Als erstes bindet das Kupferteilchen aus der Elektrolyt-Lösung an der Kupferoberfläche als adsorbiertes Metallatom. Der Begriff Adsorption stammt vom lateinischen Verb adsorbere, was soviel wie ansaugen heißt. Dabei werden die das angesaugte Ion umgebenden Wassermoleküle, die sogenannte Hydrathülle, abgestreift. Das so auf der Metalloberfläche gebildete Ad-Atom hat seine Valenzelektronen jedoch noch nicht an das Elektronengas des Metalls abgegeben. Dazu muss das Ad-Atom auf der Metalloberfläche anschließend an eine günstige Stelle diffundieren, also an einer der oben erwähnten Ecken oder Kanten. Dort wird das Ad-Atom erst fest in das Kristallgitter der Metalloberfläche integriert.
Die elektrochemische Abscheidung des Kupfers erfolgt also nicht in gleichmäßigen Schichten, sondern in Form von feinen Ästchen und Zweigen, die jeweils aufgrund von durch die Diffusion und Abscheidung der Ionen zufällig entstandenen Unregelmäßigkeiten erneut weiter verzweigen können, weil dort, wie oben erwähnt, das elektrische Feld am größten ist. Solche Stellen sind also, wenn man so sagen will, besonders attraktiv für weitere Metall-Ionen, die aus der Elektrolyt-Lösung abgeschieden werden. So entsteht nach und nach durch diesen sich selbst verstärkenden Effekt ein elektrochemisches Bäumchen. [2, 3, 4, 5]
Für mathematisch Interessierte: Der Prozess der Bildung von fraktalen Strukturen kann sehr gut modelliert werden. Ein gängiges Modell, das mit den realen „Bäumchen“ gut übereinstimmt, nennt sich Diffusion-Limited-Aggregation-Modell [6].

Bild 8: Die Struktur (grün), die sich durch die Anlagerung der roten Teilchen in der DLA-Simulation gebildet hat, ist dem Kupferbäumchen sehr ähnlich.
(Sceenshot:aus [6])
Die Musterbildung entsteht im DLA-Modell durch zwei Prozesse. Zum einen bewegen sich zufällig Teilchen – das ist die Diffusion -, zum anderen haften diese aneinander, wenn sie aufeinandertreffen – das ist die Aggegation. So bilden sich die fraktalen Baumstrukturen, die von wenigen Faktoren abhängen, sich immer ein wenig voneinander unterscheiden, weil der Zufall eine entscheidende Rolle spielt.
Wer dies erproben möchte, dem sei eine interaktive Simulation [6] empfohlen, bei der die Parameter verändert werden können. Es gibt auch den Vorschlag eines DLA-Brettspiels, für dessen Erprobung man wesentlich mehr Zeit benötigt [Gesetz und Zufall: Ein DLA-Brettspiel; in: [2], S. 332]. Viel Spaß damit!
Literatur:
[1a] Experiment 4 „Elektrolyse einer Kupfer(II)-sulfatlösung an Kupferelektroden (Kupferbäumchen), in: Chemie Oberstufe, Gesamtband, Cornelsen Verlag 2010, S. 242.
[1b] vgl. H.W. Roesky, K.Möckel: Chemische Kabinettstücke, 1. Aufl., VCH, Weinheim, New York, Basel, Cambridge, Tokyo, 1994, S.7 oder online: Didaktik der Chemie der Universität Bayreuth: Petrischalenversuch Silberbäumchen; http://daten.didaktikchemie.uni-bayreuth.de/experimente/effekt/video_silberbaeumchen.htm (zuletzt abgerufen am 1.2.2022)
[2] Prinzipien der Selbstorganisation - Untersuchungen zu Strukturbildenden Prozessen und Entwicklung einer experimentellen Konzeption zur Einbindung dieser Thematik in einen zeitgemäßen Chemieunterricht; H. Kunz, Dissertation 2001; abrufbar unter http://docserver.bis.uni-oldenburg.de/publikationen/dissertation/2001/kunpri01/pdf/kap063.pdf (zuletzt abgerufen am 1.2.2022)
[3] Diffusion-limited aggregation: A kinetic critical phenomenon? Leonard M. Sander, Contemporary Physics, 41:4 (2000), p. 203-218
[4] Fractal growth of copper electrodeposits, Brady, R., Ball, R., Nature 309 (1984), p. 225–229.
[5] The role of the anions in the growth speed of fractal electrodeposits, V.Fleury, J.-N. Chazalviel, M. Rosso, B. Sapoval, J. Electroanal. Chem., 290 (1990), p. 249-255.
[6] DLA Alternate - Interaktive Simulation des DLA-Modells: Wilensky, U., NetLogo. Center for Connected Learning and Computer-Based Modeling, Northwestern University 1999, Evanston, IL. http://www.netlogoweb.org/launch#http://ccl.northwestern.edu/netlogo/models/models/Sample%20Models/Chemistry%20&%20Physics/Diffusion%20Limited%20Aggregation/DLA.nlogo (zuletzt abgerufen am 1.2.2022)
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 2. Mai 2022, Fritz Franzke
