Prof. Blumes Bildungsserver für Chemie
Tipp des Monats Januar 2023 (Tipp-Nr. 307)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
CO-Sensor – eine lebensrettende Spürnase
Uwe Lüttgens
Bild 1: Hunde sind sehr gute Spürnasen – jedoch nicht für Kohlenstoffmonoxid.
Nach einem langen Winterspaziergang mit unseren Hunden freuen wir uns, wenn der Kaminofen prasselt und behaglich knistert, während draußen der Schnee eine herrliche Winterlandschaft zaubert. Die wärmende Strahlung eines Kaminofens verbreitet wohlige Wärme in jeder Wohnstube. Gleichzeitig lauert die unsichtbare Gefahr Kohlenstoffmonoxid CO, „der leise Mörder im Haus“. Bild 2: Wohlige Wärme am Kaminofen
Das farb- und geruchlose Gas entsteht, wenn das Holz im Ofen unvollständig verbrennt, also zu wenig Sauerstoff vorhanden ist, damit der Kohlenstoff zum Kohlenstoffdioxid zu reagieren. Es ist an der blauen Flamme zu erkennen, mit der es unter starker Wärmeentwicklung zu Kohlenstoffdioxid verbrennt [1]: CO + ½ O2 → CO2 + 283,17 kJ Bild 3: Für eine vollständige Verbrennung von Holz im Ofen muss die Luftzufuhr gut geregelt werden. In der Glut läuft die Verbrennung dann unvollständig ab, weil wenig Sauerstoff zugeführt wird.
Das brennbare Gas ist ähnlich schwer wie Luft. Dies erkennen wir daran, dass die Molekülmasse m(CO) = 28 u ungefähr dem Mittelwert der Molekülmassen von Stickstoff N2 (~78 %), Sauerstoff O2 (~21 %) und Argon Ar (~1%), den beiden Hauptbestandteilen von Luft, mit circa 29 u entspricht. Die Dichte von 1,25 kg / m3 von Kohlenstoffmonoxid ähnelt ebenfalls der von Luft mit ~1,2 kg / m3. Aus unseren Überlegungen zur Dichte des tückischen Gases im Vergleich zur Atemluft lässt sich folgern, dass CO-Warnmelder in Innenräumen in der Nähe eines Kaminofens oder einer anderen potenziellen CO-Quelle angebracht werden sollten. Hersteller empfehlen einen Abstand von ca. 1 bis 3 Metern; weiter sollte ein CO-Sensor nicht angebracht werden. Weitgehend unbekannt ist, dass Kohlenstoffmonoxid durch Wände, Decken und Böden auch in andere Räume eines Hauses eindringt. Eine Untersuchung zur Brandschutzforschung [3] stellt zusammenfassend fest: „Insgesamt kann die CO-Permeation bei den vorliegenden Baustoffproben als relativ schnell erfolgend bewertet werden und zwar in Mengen und Zeiten, die toxisch relevant sind.“ Übersetzt heißt das: Das Gas ist doppelt heimtückisch. Wir können es weder riechen noch schmecken und durch Wände gehen kann es auch. Denn Beton, Gips und Holz stellen kein Hindernis dar – die kleinen Moleküle diffundieren einfach durch diese Baustoffe hindurch. Der Feuerwehr wird auch deshalb empfohlen, bei Einsätzen immer ein CO-Warngerät mitzuführen. Und die Bevölkerung soll über die CO-Problematik aufgeklärt werden. Auch sollte darüber nachgedacht werden, eine CO-Warnmelderpflicht im häuslichen Umfeld einzuführen. [vgl. [3] S. 69] Skizze 1: Der Aufbau eins CO-Sensors: Auf eine Trägerschicht aus Aluminiumoxid werden die Elektroden und ein Heizdraht aus Platin aufgebracht. Der Sensorschicht aus Zinnoxid befindet sich zwischen den Elektroden.
Gassensoren bestehen aus einem Metalloxid, beispielsweise aus Zinndioxid SnO2. Mit diesem halbleitenden Material begann in den 1960er Jahren ein wissbegieriger Japaner zu experimentieren, Naoyoshi Taguchi. Überhaupt aufmerksam auf das Problem fehlender Gassensoren wurde der Ingenieur durch einen Unfall mit Flüssiggas, das unter dem Begriff LPG seit der Energiekrise 2022 jeder schon mal gehört hat. Auf den Unfall, bei dem zehn Menschen starben, aufmerksam wurde der neugierige Ingenieur beim Lesen einer alten Tageszeitung. Taguchi hatte damals keine Ahnung von halbleitenden Materialien und der Absorption von Gasen, als er darüber nachdachte, wie diese zehn Menschenleben hätten gerettet werden können. Ein Detektor musste her. Den wollte der experimentierfreudige, junge Japaner entwickeln. Das Einzige, was er damals wusste, so sein Chronist Akira Chiba [4], war, dass ein Draht aus Kupferoxid mit dem Bunsenbrenner zu elementarem Kupfer reduziert wird und dass ein Metall ein besserer elektrischer Leiter ist als ein Metalloxid. Seine Idee: Die Änderung der Leitfähigkeit, wenn Metalle oxidiert und wieder reduziert werden. Bei seinen Versuchen landete er schließlich bei Zinnoxid, weil der Halbleiter bei relativ niedrigen Temperaturen empfindlich seinen elektrischen Widerstand ändert und dabei seine Kristallstruktur nicht ändert, wenn er mit Gasen in Kontakt kommt. Der nach seinem Erfinder auch als Taguchi-Sensor bezeichnete Detektor wurde 1968 von der Firma Figaro Engeneering [5] in Japan kommerzialisiert, einem führenden Hersteller von Gassensoren. Das Prinzip erscheint einfach: Die empfindliche Schicht des Sensors hat an der Luft einen elektrischen Widerstand, der von der Temperatur abhängig ist und sich reproduzierbar verringert, wenn oxidierbare Gase wie Kohlenstoffmonoxid vorbeiströmen. Steigt also die Konzentration von CO, dann steigt auch die Leitfähigkeit des Gas-Sensors. Was passiert genau an der porösen Schicht, die nur so dick ist wie ein menschliches Haar ist. Und wie kann Kohlenstoffmonoxid die elektrische Leitfähigkeit des Halbmetalls beeinflussen, wenn das Gas an dem 50 Mikrometer dicken Zinnoxidkristall vorbeiströmt? Skizze 2: Zwischen die Körner der porösen Sensoroberfläche kann das Gas hindurchströmen, um dort zu chemisch zu reagieren.
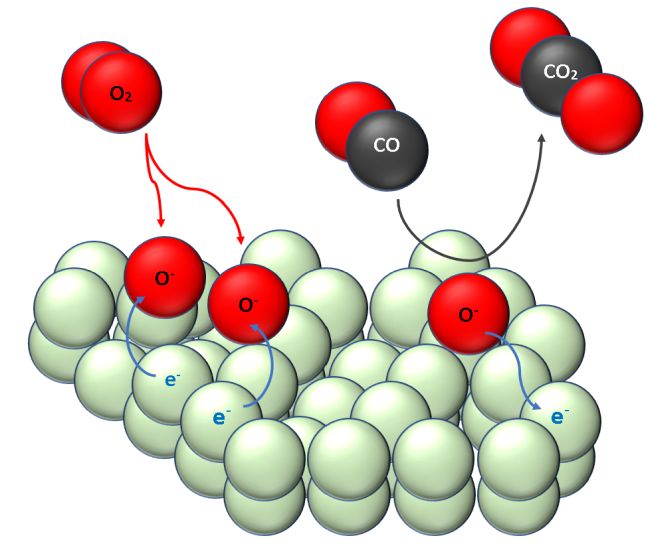
Dazu schauen wir uns die Oberfläche genauer an. Diese ist keinesfalls glatt wie ein Kinderpopo, sondern zerklüftet und rau. Die poröse Schicht ähnelt einer Kraterlandschaft, die aus körnigen Erhebungen und zerklüfteten Tälern geformt ist. Dort kann der Sauerstoff aus der Luft tief eindringen, um dort festgehalten und gebunden zu werden. So lange, bis das adsorbierte Sauerstoffmolekül zwei Elektronen e- aufgenommen hat, in zwei geladenen Sauerstoff-Ionen O- zerfallen ist und schließlich die Atmosphäre über der Oberfläche, wie eine pelziger, negativ geladener Sauerstoff-Flaum, bedeckt. [6] Die Hügel und Täler des Metalloxids sind also von einer dünnen „Atmosphäre“ aus ionisiertem Sauerstoff O- umgeben. Strömt nun Kohlenstoffmonoxid in diese geladene Sauerstoffatmosphäre, wird das reduzierende Gas vom reaktiven Sauerstoff-Ion O- dort zu Kohlenstoffdioxid oxidiert. Das Reaktionsprodukt strömt aus der porösen Kraterlandschaft zurück in den Gasraum und lässt dabei ein Elektron zurück. Und das hat Folgen: Denn die durch diese Oxidation freigesetzten Elektronen wandern anschließend wieder in die Oberfläche des Halbleiters zurück und erhöhen damit die Leitfähigkeit des Sensors, und zwar in Abhängigkeit von der Konzentration an Kohlenstoffmonoxid. Dies ist die Grundlage der CO-Messung eines Gassensors. Skizze 3: Sauerstoff-Moleküle O2 aus der Luft werden an der Zinnoxid-Oberfläche adsorbiert. Die Moleküle dissoziieren in zwei Sauerstoffatome, die jeweils ein Elektron aufnehmen können und als geladene Sauerstoff-Ionen O- auf der Zinnoxid-Oberfläche adsorbieren. Vorbeiströmenden Kohlenstoffmoxid-Moleküle können nun mit den Sauerstoff-Ionen O- zu Kohlenstoffdioxid-Molekülen CO2 reagieren, die von der Oberfläche anschließend wegdiffundieren.
Noch ein wenig physikalische Chemie: Zwischen den einzelnen Hügeln und Tälern des polykristallinen Materials variiert der Widerstand, tiefer im Innern des Kristalls ist hingegen die Leitfähigkeit eher konstant. Man spricht von unterschiedlich hohen Potenzialbarrieren zwischen den Körnern. Die Spannung ist in dieser Nanostruktur also keinesfalls konstant, sie ist auch „hügelig“, denn sie steigt von Korn zu Korn immer wieder an, um danach erneut abzusinken. Skizze 4: An den Korngrenzen eines Gas-Sensors Kohlenstoffmonoxid gibt es eine Potenzialbarriere, die den Fluss der Elektronen hemmt (blaue Linie). Kohlenstoffmonoxid setzt die Potenzialbarriere an den Korngrenzen eines Gas-Sensors Barriere an den messbar herab (rote Linie). Dieser Effekt, der den Widerstand herabsetzt, wird im CO-Gassensor ausgenutzt.
Für Elektronen stellen diese Korngrenzen deshalb eine Barriere dar auf ihrem Weg von der Kathode zur Anode in einem Stromkreis. Diese Elektronen-Barriere wird nun durch das Gas Kohlenmonoxid deutlich herabgesetzt. Vielleicht lässt sich die Situation vergleichen mit einem Hindernis beim Parcours-Reiten: Ein für ein nicht so sprunggewaltiges Pferd – das Elektron – unüberwindlich erscheinendes Hindernis im Parcours, beispielsweise ein Oxer – übersetzt ist das eine Potenzialbarriere im Stromkreis – , wird rasch vom unsichtbaren Helfer, dem Gas Kohlenstoffmonoxid, so stark verringert, dass es den Sprung gefahrlos und erfolgreich wagen kann, um danach fehlerlos gen Ziel, sprich zur Anode weiterzureiten.

(Foto: Lüttgens)
(Foto: Lüttgens)
(Foto: Lüttgens)
Was sagt die Feuerwehr?
Normalerweise liegt die Konzentration an Kohlenstoffmonoxid in der Raumluft zwischen 0,5 und 5 ppm – also 0,5 bis 5 Teilen CO von einer Millionen Teilen Luft. Die Feuerwehr empfiehlt Rettungskräften für deren Einsätze, ein Warngerät mitzuführen, um sogenannte Warnschwellen zu erkennen. Liegt die Konzentration über 30 ppm, sollten Türen und Fenster geöffnet werden. Oberhalb von 60 ppm sollten aufgrund der starken Gefährdung auch der Feuerwehrleute bereits vergiftete Menschen schnell gerettet werden. Ist die Konzentration an CO höher als 200 ppm, wird’s richtig gefährlich, die Feuerwehr empfiehlt jetzt den Einsatz von Atemschutz sowie die laufende Beobachtung eines CO-Warngerätes. Oberhalb von 500 ppm bleibt nur der Rückzug der Rettungsmannschaft, wenn kein Atemschutz zur Verfügung steht. [2]
Für Spezialisten: Wie funktioniert ein CO-Warngerät?
In den Anleitungen der Hersteller von CO-Meldern steht häufig als einzige Information zur Funktionsweise, dass das Gas elektrochemisch detektiert und dabei ein integrierter Sensor eingesetzt wird. So weit so unklar. Und eine interessante Frage für einen Tipp des Monats. Schauen wir uns einen solchen Senor etwas genauer an. 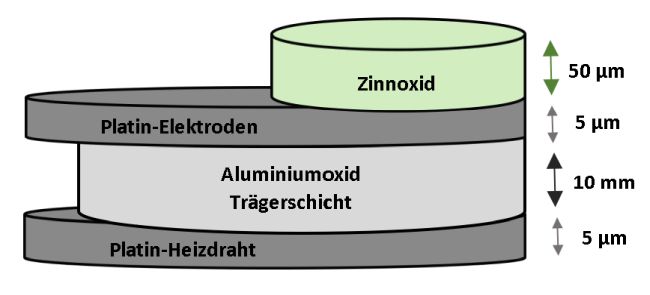
(Skizze: Lüttgens)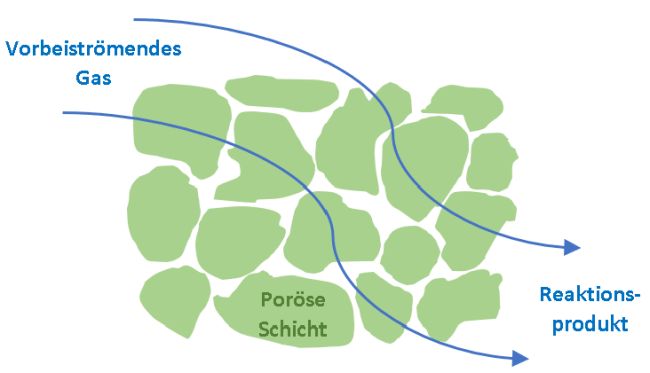
(Skizze: Lüttgens)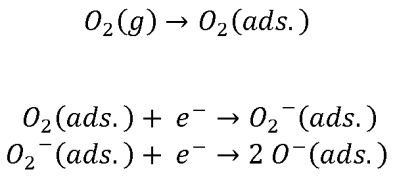
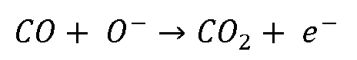
(Skizze: Lüttgens)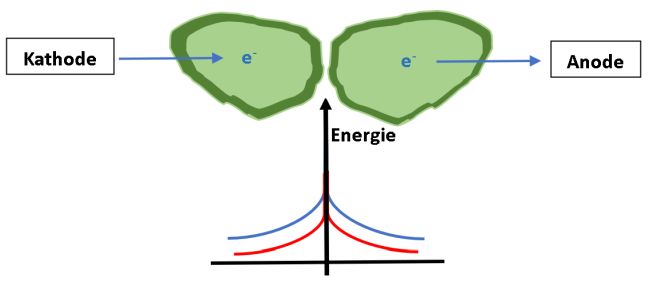
(Skizze: Lüttgens)
Literatur:
[1] Holleman Wiberg, S. 898
[2] Fachbereich AKTUELL: Einsatz von Kohlenmonoxidwarngeräten bei Feuerwehren und Hilfeleistungsorganisationen; FBFHB-021; DGUV 2020
[3] Untersuchung der Diffusion von Kohlenstoffmonoxid durch Baustoffe; Brandschutz-Forschung der Bundesländer; Forschungsbericht Nr. 195; Institut für Brand- und Katastrophenschutz Heyrothsberge (2019)
[4] A. Chiba: Development of the TGS Gas Sensor, S. 2 ff. in: Chemical Sensor Technology, Volume 4, Band 4, Elsevier 1992]
[5] FIGARO ENGINEERING INC.; https://www.figaro.co.jp/en/ (abgerufen am 27.12.2022)
[6] O. Sachlara: Impedanzspektroskopie an SnO2-Dickschicht-Sensoren; Dissertation der Eberhard-Karls-Universität Tübingen (2005)
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 3. Januar 2023, Fritz Franzke