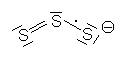
Warum ist das Schwefel-Anion blau?
Einige Leser haben angeregt, noch etwas über die Farbigkeit der Trischwefel-Anionen zu sagen.
Bei den S3--Ionen handelt es sich natürlich nicht um einfache Anionen. Denn die ungerade Elektronenzahl und das damit verbundene einzelne Elektron machen sie zu Radikal-Anionen. Diese dürften aber gar nicht stabil sein. Da sie aber im Kristallgitter des Alumosilicats sozusagen in Einzelhaft gefangen sind, bleiben sie erhalten. Durch das einzelne Elektron ist das Elektronensystem der Radikal-Anionen schon durch sichtbares Licht anregbar. Das heißt, sie absorbieren Strahlung aus dem Bereich des sichtbaren Lichts. Da dies den mittleren Spektralbereich betrifft, erscheint der Rest als "Eigenfarbe" des Lazurit blau. Übrigens ist das S3--Ion paramagnetisch, was ebenfalls für den radikalischen Charakter spricht. Das Molekül-Ion ist außerdem gewinkelt.
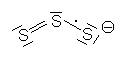
Bricht das Gitter auf oder werden die Radikal-Ionen mit Säuren oder Wasser aus dem Gitter gelöst, reagieren sich die Schwefelradikale in der Art ab, dass sie dimerisieren. Es bilden sich dann zunächst nichtradikalische und deshalb farblose S62--Anionen, die allerdings nicht allzu stabil sind.
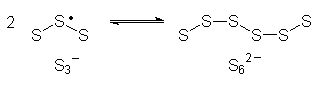
Sie disproportionieren in Gegenwart von Wasser oder Säuren spontan zu Schwefel und den bekannten S2--Anionen, die mit Säure zu Schwefelwasserstoff reagieren.
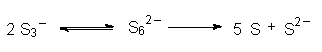
Es gibt noch andere Radikal-Anionen des Schwefels: Das S2--Ion ist gelbgrün gefärbt, das S4--Ion rot. Sie sind in den nicht blauen Ultramarin-Farbstoffen enthalten.
In diesem Zusammenhang ist es interessant zu wissen, dass es vom Ozon das analoge stabile Radikal-Anion O3- (Ozonid-Anion) gibt. Es ist isoelektronisch zum S3--Ion. Wie das Schwefel-Anion ist es paramagnetisch, reagiert heftig mit Säuren und Wasser, allerdings unter Sauerstoffbildung. Auch ihre Geometrien entsprechen einander. Und außerdem ist es intensiv rot gefärbt - wie auch das analoge, allerdings ungeladene Radikalmolekül Chlordioxid ClO2. Erinnern wollen wir uns auch an das dunkelbraune Stickstoffdioxid NO2.
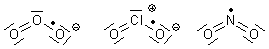
Wer noch mehr wissen will, lese in Holleman-Wiberg: Lehrbuch der Anorganischen Chemie nach.