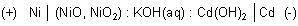
2 Cadmium
Cadmium und seine Verbindungen stehen heute wegen ihrer Toxizität im Interesse der Öffentlichkeit. Allerdings scheint es bislang umstritten, wie gefährlich Cadmium und seine Verbindungen wirklich sind. So waren manche, schwerer lösliche Cadmiumverbindungen wie das Sulfid CdS vor kurzem noch wichtige Bestandteile von Medikamenten gegen Hautkrankheiten (z. B. Ichtho-Cadmin; 50 g dieser Salbe enthalten 1 g Cadmiumsulfid). Wenn Reste der Salbe verbrannt werden, bildet sich Cadmiumoxid CdO, das wegen seiner Flüchtigkeit (Sublimation) die gefährlichste Cadmiumverbindung überhaupt ist.
Der Giftigkeit von Cadmiumoxid ist man sich erst seit 50 Jahren bewusst. Und dabei ist das Oxid so giftig wie das Phosgen COCl2. Der MAK-Wert beträgt 0,1 mg/m3 Luft. Typische akute Vergiftungserscheinungen sind Lungenödeme.
Besonders charakteristisch ist die Wirkung von Cadmium auf die Knochensubstanz, aus der es Calcium verdrängt, was zu einer Versprödung der Knochen führt. Diese schwerwiegende Cadmiumvergiftung lag bei der Itai-Itai-Krankheit ("Aua-Aua-Krankheit") vor, von der Fischer und Reisbauern in der Nähe einer japanischen Zinkhütte ohne ausreichende Abgasreinigung betroffen waren.
Neuerdings werden Cadmiumoxid und Cadmiumchlorid zu den Stoffen mit Verdacht auf Cancerogenität gezählt.
Auf molekularbiologischer Ebene beruht die Wirkung von Cadmium weiter auf der Bindung an Proteine. Hinzu kommt auch der Antagonismus zum Spurenelement Zink.
Viele Lebensmittel, vor allem Waldpilze, aber auch tierische Innereien wie Leber und Niere enthalten besonders viel von dem giftigen Element. Der Cadmiumgehalt des Bodens und reziprok dazu seine Tendenz zur Cadmiumabgabe hängen vom Gehalt an komplexierenden Huminsäuren ab. Bedenkt man, dass die Pilze ganz besonders oberflächennah leben und vor allem Huminsäuren abbauen, so wird auch der hohe Cadmiumgehalt in Pilzen verständlich.
Weizen und Leinen akkumulieren dieses Schwermetall im Gegensatz zu Roggen so stark, dass man mit ihnen sogar belastete Böden entsorgen kann.
Auch im Zigarettenrauch ist Cadmiumoxid enthalten. So erhöht sich beim Konsum von 10 Zigaretten pro Tag die tägliche Cadmiumaufnahme um 30 %.
2.1 Technische Anwendungen von Cadmium
Cadmium ist dem Zink und Quecksilber chemisch sehr ähnlich und liegt folglich stets in Zinkmineralien (wenn auch in geringen Mengen) vor. Es hat bei 200 °C bereits einen Dampfdruck von ca. 10-3 bar. Aus dem Dampf des unedlen Metalls bildet sich sofort flüchtiges Cadmiumoxid, welches als dünner Film leicht Anlauffarben ("Pfauenauge") bildet. Cadmium wird deshalb primär aus den Flugstäuben bei der Zinkverhüttung gewonnen.
Cadmium ist aus der Technik nicht mehr wegzudenken. Hier kann man eine Vorstellung davon bekommen, welche bedeutende Rolle ein Schwermetall trotz seinem vergleichsweise äußerst geringen Vorkommen und seiner Giftigkeit spielt. Dabei bleibt die insgesamt pro Jahr benötigte Cadmiummenge von ca. 1.800 t annähernd konstant.
Farben
| - | Pigmentfarben wie Cadmiumsulfid (CdS; gelb) und Cadmiumselenid (CdSe; rot). Letzteres findet vor allem bei der Färbung von Selenrubingläsern, mit denen die teuren Goldrubingläser nachgeahmt werden, oder bei der Herstellung von roten Selenglasuren Verwendung. |
| - | Rötliche Lüsterfarben (Anlauffarben) für Jugendstilglas, Keramik, Porzellan sind u. a. aufgedampfte Cd-Verbindungen. |
| - | Leuchtstoffröhren enthalten häufig Pigmente auf Zink- oder Cadmiumbasis (Sulfide oder Silikate), die die UV-Strahlung des Primärvorganges in sichtbares Licht umwandeln (Phosphoreszenz). Dadurch wird der Wirkungsgrad der Lichtquelle stark erhöht. |
Elektrotechnik
| - | Elektroden im Cd/Ni-Akkumulator enthalten Cd-Überzüge und Cd-Verbindungen. |
| - | Gleichrichter entfalten ihre Wirkung durch Cd/Ni-Kontakte. |
| - | Elektrisch leitende Überzüge auf Kunststoffen werden u. a. durch Aufdampfen von Cadmium im Vakuum hergestellt, wodurch die schnelle Bildung von CdO verhindert wird. |
Korrosionsschutz
| - | Cadmium ist eigentlich unedel, bildet aber rasch einen dünnen, festhaftenden Oxidbelag aus (Passivierung). Es kann deshalb als Überzug andere unedle Metalle vor Oxidation schützen. |
| - | Es ist deswegen Bestandteil von älteren Rostschutzfarben. |
| - | Cadmiumüberzüge stellt man durch Elektrolyse von CdSO4- oder [Cd(CN)4]2--Lösungen (Galvanik, Cadmieren) her. |
Legierungen
| - | Niedrigschmelzende Legierungen für Sprinkleranlagen (z. B. Woodsches Metall; Schmelzpunkt 70 °C). |
| - | Lagermetalle für schnelldrehende Motoren sind Cd-Legierungen (z. B. 97 % Cd + Ni, Cu, Ag). |
| - | Lotmetalle waren früher cadmiumhaltige Legierungen. Sie dienten zum Löten von Aluminium, Gold und Silber. Dabei wurde besonders viel CdO freigesetzt. Lungenödeme waren die entsprechende Berufskrankheit. |
Kerntechnik
| - | Cadmium absorbiert leicht Neutronen und vermag deshalb Kettenreaktionen abzubremsen. Aus diesem Grund erfolgt die Schnellabschaltung von Kernreaktoren durch Regelstäbe aus Cd. |
Katalysatoren
| - | Ein Beispiel unter vielen ist der cadmiumhaltige Mischkatalysator bei der Methanolsynthese aus Kohlenmonoxid und Wasserstoff. |
Kunststoffstabilisatoren
| - | Cadmiumstearat, das Cd-Salz der Stearinsäure, schützt neben analogen Pb- und Cu-Salzen PVC und andere Kunststoffe gegen Lichteinflüsse. Es sorgt für dauerhafte Transparenz und bewirkt gleichzeitig Verbesserung der Wetterbeständigkeit etwa bei Fensterrahmen aus PVC. Heute gibt es für Cd Ersatzstoffe. |
2.2 Der Ni/Cd-Akkumulator
Ni/Cd-Akkumulatoren sind die verbreitesten Klein-Akkus in Technik und Freizeit (Mignonzellen). Diese Elemente zeichnen sich durch besonders gute Reversibilität aus. Sie beruhen auf folgendem, allerdings vereinfachten Zellschema:
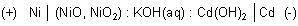
Die stromliefernde Gesamtreaktion des Ni/Cd-Elements lässt sich wie folgt formulieren:
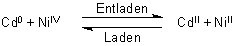
Da Cadmium giftig und selten ist, liegt es nahe, nach Wegen zu suchen, dieses Metall durch andere Metalle zu substituieren. Die aus Spannungsgründen in Frage kommenden Metalle Zink oder Eisen scheiden aus, da sie beim Ladevorgang Wasserstoff bilden, also gasen, oder sich beim Entladungsvorgang wie eine Batterie irreversibel auflösen. Cadmium dagegen hat eine sehr hohe Überspannung gegenüber Wasserstoff, so dass sich eher Cd2+ entlädt als H+.
2.3 Cadmium-Emission
Beim Erhitzen oder bei der Verbrennung von cadmiumhaltigem Material (etwa in den MVA) entstehen Dämpfe von metallischem Cadmium und Cadmiumoxid. Diese schlagen sich an den weniger heißen Stellen des Reaktionsraumes (z. B. im Flugstaubfilter oder im Schornstein) nieder oder gelangen direkt in die nähere Umgebung. Aus diesem Grunde müssen auch die Abgase der Zinkerzverhüttung ausreichend gefiltert werden. Da Cadmium auch (in geringen Mengen) in der Kohle vorkommt, sind auch die Flugaschen von Kohlekraftwerken wegen des hohen Durchsatzes von Kohle stark belastet.
Neben dem Luftpfad ist die Hauptquelle für den Bodeneintrag von Cadmium die zunehmende Düngung mit Klärschlämmen. Aber auch ungereinigte Phosphormineralien enthalten Cadmium.
2.4 Cadmium-Recycling
Da (wie gezeigt) auf den Einsatz von Cadmium vielfach nicht verzichtet werden kann und das Metall weiterhin sehr selten und teuer ist, hat man gerade für Cadmium - anders als für wesentlich häufiger vorkommende Schwermetalle wie Kupfer oder Blei - eine besonders ausgefeilte Recyclingtechnologie entwickelt. Wegen der kleinen Konzentrationen von Cadmium in seinen Produkten ist sein Recycling primär ein Anreicherungsproblem. Die Verfahren hierzu entsprechen denen der Gewinnung von Cadmium als Nebenprodukt bei der Zinkerzverhüttung, wo man die Flugstäube aufarbeitet. Beim Recycling wird deshalb cadmiumhaltiges Material erhitzt und das gebildete Cadmiumoxid mit den Flug- oder Filterstäuben aufgefangen.
Die gesammelten Flugaschen und Filterstäube werden mit Schwefelsäure ausgelaugt. Das dabei gebildete Cadmiumsulfat wird mit Zinkstaub zum Metall reduziert (zementiert).
Eine große Rolle spielt auch die Rückgewinnung von Cadmium aus Galvanikbädern durch saure Ionenaustauscher. Bei diesen werden Metall-Ionen reversibel gegen H+-Ionen ausgetauscht:
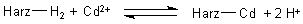
Neuerdings bedient man sich hierzu komplexierender Ionenaustauscher, die Cadmium-Ionen selektiv zu binden vermögen.