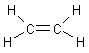
Chemie rund um das Ethen
Experimente:
Versuch: Darstellung von Ethen aus Ethanol und Schwefelsäure
Versuch: Brennprobe mit Ethen
Versuch: Addition von Brom an Ethen
Versuch: Baeyer-Probe mit Ethen
Ethen, auch Ethylen genannt, ist ein ungesättigter Kohlenwasserstoff mit einer Doppelbindung.
Es ist der einfachste Vertreter der Alkene.
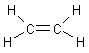
Ethen
Gewonnen wird Ethen durch Cracken von Erdgas, Erdöl oder über Eliminierungsreaktionen wie der Eliminierung von Brom aus 1,2-Dibromethan oder der Dehydratisierung von Ethanol mit katalytischer Schwefelsäure (-> Versuch). Die Herstellung läuft nach dem Mechanismus einer Eliminierung. Dieses entspricht der Rückreaktion einer Addition an die Doppelbindung.
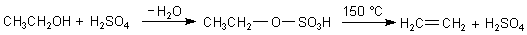
Der Vorgang ist zweistufig und besitzt leider aus der ersten Reaktionsstufe heraus die Bildung von Diethylether als Konkurrenzreaktion.
Bedeutung des Ethens für die Chemietechnik
Auf Ethen beruht ein Großteil der weltweiten Chemie- und Kunststoffindustrie. Eine Unmenge organischer
Verbindungen wird aus diesem einfachsten Alken großtechnisch synthetisiert. Vor allem Kunststoffe
wie das Polyethen (PE) sind wohl jedem bekannt. Es gibt viele Abkömmlinge des Ethens wie Styrol, Acrylsäureester
usw., die alle nach dem gleichen Prinzip miteinander reagieren. Das macht Ethen für die Industrie und Wirtschaft
so wertvoll, dass es quer durch Deutschland auf ausgedehnten Pipelinesystemen von Chemieindustriestandort zu
Chemieindustriestandort transportiert wird.
Ohne Ethen gibt es keine reifen Bananen
Auch in der Natur finden wir Ethen, zum Beispiel als vielseitiges pflanzliches Hormon. Neben Wachstumsprozessen
verschiedener Pflanzengewebe steuert Ethen Alterungsvorgänge wie vor allem die Fruchtreifung. Das weiß indirekt
auch die Hausfrau: Sie wird niemals Äpfel und Bananen zusammen in eine Obstschale legen. Denn Äpfel produzieren
Ethen, das wiederum Bananen rasch braun werden lässt. Die gelben Bananen, die man im Supermarkt kauft, haben
ihre einwöchige Überseereise noch unreif und grün angetreten. Erst kurz vor oder nach Eintreffen am Zielort
werden sie in Reifekammern kurzzeitig mit Ethen begast, um den Reifungsprozess zu starten und sie als schöne,
gelbe Früchte verkaufen zu können.
Verbrennung von Ethen
Wie alle bei Normalbedingungen gasförmigen Kohlenwasserstoffe verbrennt auch Ethen mit Luftsauerstoff (->
Versuch). Da Ethen in der Nachkriegszeit teilweise sogar als Kraftstoff für Autos
verwendet wurde, ist zu erwarten, dass bei der Ethenverbrennung viel Energie freigesetzt wird.

Bild 1: Abbrennen der Ethenfüllung eines Glaszylinders
(Foto: Andreas)
Bei der Verbrennung von Ethen bildet sich nur wenig Ruß, aber deutlich mehr als bei der Verbrennung von Methan.
Die Flamme brennt sehr ruhig an der Kontaktstelle des Luftsauerstoffs mit dem Ethen. Der Versuch zeigt auch, dass Ethen
und Luft fast gleich dicht sind (ρ ~ 1,2 g/l (15 °C)). Deshalb kann das Reaktionsgefäß (anders als beim Arbeiten mit
Wasserstoff oder Methan!) während des Anzündens kurzzeitig offen stehen, ohne dass das Ethen nennenswert entweicht.
Nachweise für Ethen und andere Alkene
1 Addition von Brom
Am Beispiel des Ethens ist auch sehr schön die Addition an die Doppelbindung der Alkene zu zeigen
(-> Versuch). Hierbei brauchen wir nicht einmal umzuschütteln, um eine Reaktion
beobachten zu können. Das Bromwasser entfärbt sich schon beim Eintropfen in den Gasraum des Zylinders.
Ethen addiert also sehr leicht Brom. Weiteres hierzu findet man hier: Addition
von Brom - ein wichtiger Nachweis.
2 Baeyer-Probe
Der zweite wichtige Nachweis für die Doppelbindung der Alkene ist die Baeyer-Probe.
Auch das gasförmige Ethen kann durch Kaliumpermanganat an der Doppelbindung oxidiert werden.
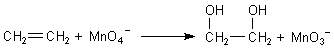
Aus dem Manganat(V) bildet sich anschließend Braunstein.
Da Ethen schwerer als Luft ist, sinkt es in einem Standzylindern nach unten. Stellt man einen mit Ethen gefüllten Standzylinder kopfüber auf einen zweiten Zylinder, in dem sich Kaliumpermanganatlösung befindet, ist der Reaktionsverlauf der Baeyer-Probe besonders gut zu beobachten (-> Versuch). Die obere Schicht der violetten Kaliumpermanganatlösung färbt sich bei Kontakt mit dem Gas schnell braun.
 |
| Bild 2: Links: Sodaalkalische Permanganatlösung und Ethen vor dem Versuch
Mitte: Reaktion in der oberen Schicht der Lösung bei Kontakt mit Ethen Rechts: Reaktionslösung nach dem Umschütteln (Fotos: Andreas) |
Weitere Texte zum Thema „Kohlenwasserstoffe“