
Grünspan
Experimente:
Versuch: Grünspan selbst hergestellt
Versuch: Kupferoxid zersetzt sich in Essigsäure

Bild 1: Kirche mit grünem Dach
(Foto: Blume)
Jeder kennt sie, die hübschen grünen Kirchendächer. Wenn sie mit frischem Kupfermetall belegt
werden, blinken sie schön im Sonnenlicht. Aber nicht lange: Sie verlieren rasch ihre blanke kupferrote
Farbe, dunkeln nach und werden matt.

Bild 2: Kirche mit Kupfer-Dach - drei Jahre nach der Belegung
(Foto: Blume)
Nach einiger Zeit werden die Dächer sogar grün. Man sagt: Sie überziehen sich mit Grünspan.
Das ist genau genommen nichts anderes als korrodiertes Kupfer, sozusagen Kupferrost.
Nicht jedes Metall korrodiert! Deshalb bleiben die Turmspitzen immer glänzend, denn sie sind aus
Gold oder wenigstens vergoldet!
Kupferrost ist etwas ganz anderes als Kupferoxid! Wir sollten deshalb Kupferrost mit dem Eisenrost vergleichen. Eisenrost ist basisches Eisenoxid, zum Beispiel Eisen(III)-oxid-hydroxid FeO(OH). Hinzu kommen noch Anionen wie zum Beispiel Carbonat oder Chlorid.
Auch Grünspan ist eine schwerlösliche Mischverbindung. Basis ist das schwer lösliche Kupfer(II)-hydroxid Cu(OH)2, um die sich andere Anionen wie das Carbonat oder Acetat gruppieren. Wie stabil solche Salze sind, erkennen wir schon daran, dass es eine Reihe bekannter, prächtiger Kupfermineralien gibt, die chemisch nichts anderes als Kupferhydroxid-carbonate sind. Farbliche Extrem-Beispiele sind der grüne Malachit Cu2(OH)2(CO3) = CuCO3 · Cu(OH)2 und der blaue Azurit Cu3(OH)2(CO3)2 = 2 CuCO3 · Cu(OH)2. Es gibt viele Mineralien, deren Zusammensetzung zwischen diesen beiden Extremen liegt.
Wie entsteht Grünspan?
Kupfer ist ein Halbedelmetall. Deshalb löst es sich fast nicht in Wasserstoff-Säuren auf; und
Sauerstoff sollte es wenig angreifen können. Aber zusammen bewirken beide Wunder. Eine Vorstellung
darüber, wie das funktionieren könnte, gibt uns dieser Versuch.
Wir sehen, dass sich sauberes Kupfer in Essigsäure nicht zersetzt, wohl aber, wenn Sauerstoff
hinzutreten kann. Deshalb bildet sich Grünspan an der Grenze zwischen Flüssigkeit und Luft.
Wir haben es hier also mit der Mischung zweier Korrosions-Typen zu tun: Säurekorrosion und Sauerstoffkorrosion (-> Webseite).
Die grundsätzliche Primärreaktion für die Zersetzung von Kupfer wird durch das folgende Redox-Gleichgewicht beschrieben.
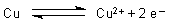
Diese Reaktion beobachten wir schon, wenn wir ein sauberes Kupferblech in Wasser tauchen: Es lädt sich negativ auf.
Zur kontinuierlichen Zersetzung des Metalls ist folglich ein Elektronenakzeptor nötig. Diese Rolle könnten eigentlich die Wasserstoff-Ionen übernehmen.
2 H+ + 2 e- ———> H2
Dann wäre die Gesamtreaktion:
Cu + 2 H+ ———> Cu2+ + H2
Das passiert leider nicht. Grund: Wenn Kupfer mit Wasser in Berührung kommt, lädt es sich zwar negativ auf, überzieht sich aber sofort mit positiven Cu-Ionen und positiv geladenen Wasserstoff-Ionen aus dem Wasser. Wenn nun noch eine Säure anwesend ist, wird diese Aktion durch deren Protonen verstärkt. Insgesamt werden jedoch nur wenige H+-Ionen entladen. Denn es gelangen nicht genügend davon an die Metalloberfläche, da die positiv geladene Grenzschicht sie davon abhält. Das heißt, das Kupfer bleibt trotz der Anwesenheit der Säure stabil.
Durch die positiv geladene Grenzschicht können aber ungeladene Sauerstoffmoleküle hindurch diffundieren. Die übernehmen die Elektronen des Kupfers, das sich dadurch zersetzen kann.
½ O2 + H2O + 2 e- ———> 2 OH-
Die OH--Ionen reagieren mit den Säureprotonen zu Wasser:
OH- + H+ ———> H2O
Die Gesamtreaktion ist also:
Cu + ½ O2 + 2 H+ ———> Cu2+ + H2O
(Ähnliches beobachten wir beim Korrodieren von verzinnten Weißblechdosen. Auch das Zinn ist wie das Kupfer ein Halbedelmetall.)
Zunächst ist die Frage nach den Säuren zu stellen, die bei der Grünspanbildung von Hausdächern
die protonenspendende Rolle spielen könnten. Säuren wie Kohlensäure, Schwefelige Säure, Schwefelsäure,
Salzsäure, Salpetersäure oder auch die Essigsäure sind genügend in der Umgebungsluft vorhanden. Denn die
Häuser stehen ja im Allgemeinen in einer Umgebung, in der durch Heizungen oder Handwerksbetriebe (wie
Essigsäurefabriken) sowie durch Kfz-Abgase viele Säuren bzw. deren Anhydride in die Luft gelangen.
Die Folgen der Einwirkung solcher atmosphärischen Einflüsse kann man sehr schön auf dem folgenden
Bild des Brunnens erkennen.

Bild 3: Grünspanbildung auf einem Bronze-Denkmal
(Foto: Blume)
Der Grünspan entwickelt sich von oben her und ist an vor Regen geschützten Stellen kaum vorhanden.
Und wir sehen, dass der Regen den Grünspan weniger abspült, sondern ihn eher verstärkt.
Nun ist nicht jedes Kupfersalz mit Grünspan gleichzusetzen. Kupfer(II)-acetat, -nitrat, -sulfat oder -chlorid sind in Wasser gut löslich. Ausnahme: Kupfercarbonat. Grünspan ist vor allem aufgrund seines Hydroxidgehalts schwerlöslich. Warum aber bilden gerade Kohlensäure oder Essigsäure Grünspan?
Es handelt sich um schwache Säuren. Wenn ihre Anhydride (CO2) bzw. Moleküle (CH3-COOH) ins Wasser gelangen, dissoziieren nur wenige Säuremoleküle. Der Anteil von verbleibenden OH--Ionen des Wassers ist somit so groß und das Löslichkeitsprodukt von Kupfer(II)-hydroxid so klein, dass sich als Basis für Grünspan schwerlösliches Kupferhydroxid bilden kann. Hinzu kommt noch, dass auch Kupfer(II)-carbonat schwerlöslich ist. Wenn wir allerdings die Lösung eines Kupfer(II)-salzes (wie Sulfat oder Chlorid) mit Natriumcarbonat-Lösung vermischen, gibt es bereits aufgrund der alkalischen Reaktion der Soda-Lösung "basisches Kupfer(II)-carbonat".
Und wenn dem Bauherrn die Grünspanbildung nicht schnell genug geht? Dann wird "Chemie" eingesetzt. Früher zum Beispiel hat man die Dächer mit Heringslake gestrichen! Das könnten wir auch versuchen: Wandeln wir einfach den Versuch ab und nehmen wir Rollmops-Saft statt Essigsäure.
Natürlich reagieren die oben genannten Säuren auch mit Kupferoxid, das immer als Überzug über Kupfer vorhanden ist (-> Versuch). Dabei bilden sich meistens nur lösliche Salze, die sich leicht abspülen lassen.
Wenn dies an einer quasi trockenen Dach-Oberfläche abläuft, bildet sich natürlich ebenfalls Grünspan.
Weitere Texte zum Thema „Essig“