 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
931
F: Ich habe da mal eine frage ich besitze ein Aquarium in dem
Ich einen Oxidator habe, welcher mit Wasserstoffperoxid und einem Katalysator betrieben wird. Es
gibt das Wasserstoffperoxid dafür für verschiedene Aquariengrößen in 3%, 6% und 30% zu kaufen da
alle Sorten den gleichen Preis haben und ich nicht unnötig Geld ausgeben wollte habe ich überlegt
ob ich nicht die 30%ige Lösung mit Destiliertem Wasser zu 6% verdünnen kann. Falls die smöglich
ist würde ich doch 1Liter 30%ige mit 4Litern Wasser verdünnen um 6% zu erhalten...Wäre sehr
schön wenn Sie mir helfen könnten...
A: Sie haben richtig gerechnet. Die mathematische Formel
zur Berechnung einer Mischung ist
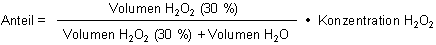
(H2O2 ist die chemische Formel von Wasserstoffperoxid.)
In Ihrem Beispiel gilt konkret:
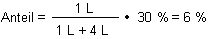
Bedenken Sie aber, dass Wasserstoffperoxid nicht lange stabil ist. Also kleine Mengen kaufen und vor allem im Kühlschrank aufbewahren!
932
F: Kann man in einem Feuerzeugs anstelle von Benzin oder
Butan Knallgas verwenden?
Damit stellt sich aber die Frage, ob Knallgas in komprimiert-flüssiger Form, wie es im Fall
von Butan ja in Feuerzeugen für gewöhnlich vorliegt, denn überhaupt noch Knallgas oder ob es
schon Wasser ist.
A: Flüssiges Knallgas ist kein Wasser, sondern eine
verflüssigte Gasmischung.
Das wird praktisch aber nicht gehen, da erstens die Temperatur viel zu niedrig sein muss,
um die beteiligten Gase zu verflüssigen. Der Druck ist so hoch, dass Sie Ihr Feuerzeug so
stabil wie eine Gashochdruckflasche konstruieren müssen.
Last but not least: Flüssiger Sauerstoff ist extrem brandfördernd und wird in Kontakt mit
Wasserstoff auch bei tiefen Temperaturen entsprechend reagieren. Das heißt, dass das verflüssigte,
komprimierte Knallgas explodieren kann.
933
F: Lieber Professor Blume,
ich muss für den Chemie Unterricht folgende Fragen beantworten:
1.Warum entweicht bei der Erhitzung (mit dem Gasbrenner) von Kochsalzlösung das Wasser und nur
das Salz bleibt übrig?
Danke schön schon mal im Vorraus,
Daniela(8.Klasse)
A: Beide Male sind gelöste Stoffe im Spiel.
Wasser ist flüssiges Lösemittel, das leicht verdampft.
1. Kochsalz ist ein Festkörper und der kann bei den üblichen Temperaturen nicht verdampft werden.
Er kristallisiert aus der Lösung aus, wenn das Wasser verschwindet (verdampft).
2. Das Kohlenstoffdioxid dagegen entweicht eher aus dem Wasser, weil es bei viel niedriger
Temperatur verdampft als Wasser. Denn es liegt bereits bei Zimmertemperatur als Gas vor, das allerdings
im Wasser gelöst ist.
Zum Unterschied der Lösungsvorgänge haben wir eine Webseite.
934
F: Moin Herr Professor Blume,
Bekanntlich liegen die Edelgase unter Standardbedingungen als einzelne Atome im Gasraum vor. He (g)
Sauerstoff und Wasserstoff bilden Moleküle. Auch viele andere Stoffe (Wasser, Ammoniak, kurzkettige
Kohlenwasserstoffe), die aus Molekülen bestehen, kann man in den gasförmigen Zustand bringen. H2O (g)
Wenn ich Metalle stark genug erhitze, sollen die Atome auch einzeln umherfliegen. Hg (g), Au (g).
Wie sieht's bei Salzen aus? NaCl kann man ja um die 900 °C zum Schmelzen bringen, so dass die
Ionen frei beweglich sind. (Ist die Anordnung immer noch ähnlich dem NaCl-Gitter, oder schwimmen
die ganz ungeordnet umher?) Was passiert aber, wenn ich die Schmelze immer weiter erhitze? Gibt es
dann einzeln umherfliegende NaCl-"Moleküle" oder fliegen die Na+ und Cl--Ionen dann einzeln umher
oder verdampft nur Chlor und Natrium bleibt zurück?
Mit erhitztem Gemüt Bodo
A: Moin Bodo!
In der Schmelze geht es kunterbunt durcheinander. Aber beim Verdampfen (ab 1465 °C) bilden sich
tatsächlich echte NaCl-Moleküle, die in der Gasphase herumfliegen.
Die thermische Energie reicht nicht aus, den Redoxprozess zur Bildung von NaCl aus den Elementen
rückgängig zu machen.
Gold (Siedepunkt 2660 °C) bildet übrigens Au2-Moleküle! (Man spricht nicht nur deshalb auch vom
Halogen der Metalle.)
Mit herzlichen Grüßen nach Ostfriesland...
935
F: Betreff: Preumatische Auffangung -was ist das?
Wie im Betreff schon...was ist verdammt nochmal eine preumatische Auffangung??? In keinem normalen
Buch findet man diesen Begriff. SOS, helft mir...bitte so schnell wie möglich...danke!!!!!!!!!!!!!
Mit freundlichen Grüßen Ines
A: Damit meint man das Auffangen eines Gases über Wasser.
Die Wanne mit dem Wasser nennt man pneumatische Wanne.
Man füllt zunächst ein Reagenzglas (oder einen Glaszylinder) mit Wasser, hält es mit einer Hand
verschlossen, dreht es um und taucht es in die Wanne. Dann lässt man das sich entwickelnde Gas
hineinströmen. Das aufsteigende Gas verdrängt das Wasser. Vorteil: Das Gas wird ohne Luft aufgefangen
- abgesehen von einem Vorlauf, da die Apparatur zu Beginn ja Luft enthält. Deshalb verwirft man die
erste aufgefangene Gasportion.