 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1421
F: Fettbrand im Abzug?
Ich würde gerne wissen, ob man in einem Abzug in einer Schule einen Fettbrand simulieren kann und dann natürlich
auch mit der Spritzflasche etwas Wasser hineinspritzen kann - oder wird der Abzug dann überlastet?
A: Überlastet wird der Abzug nicht – aber kräftig eingerußt und geschwärzt.
Das Abputzen von fettigem Ruß ist nicht sehr angenehm… Wenn die Flamme zu hoch schlägt, kann sich natürlich im Abzugssystem
nicht entfernter Ruß entzünden. Lassen Sie das also!
Machen Sie das Ganze wie wir es auf unseren Sicherheitswebseiten zeigen: Auf dem Labortisch mit Abstand zu den Schülern. Oder gehen Sie damit auf den Schulhof. Da können Sie die Flamme ohne Bedenken so richtig schön hochschießen lassen.
1422
F: Im Chemieunterricht der Klasse 12 haben wir beim Vergleich der Elemente Cobalt
(Ordnungszahl 27) eine rel. Atommasse von 58,93 ermittelt. Das nachfolgende Element Nickel (Ordnungszahl 28) hat trotz
Massenzuwachs von je einem Proton und Elektron nur eine rel. Atommasse von 58,63. Wie würden Sie diesen Widerspruch deuten?
A: 27Cobalt hat tatsächlich die relative Atommasse 58,933 u; das
größere Atom von 28Ni dagegen nur 58,693. Die Ordnungszahlen beschreiben aber nur die Zahl der Protonen. Hinzu kommen
bekanntlich die Neutronen, deren Zahl wechseln kann: -> Isotopenbegriff. Nun muss man wissen, dass natürliches Cobalt zu
100 % aus einem Isotop besteht: Co-59. Natürliches Nickel besteht dagegen aus 5 verschiedenen Isotopen:
| Ni-58 | 68,977 % |
| Ni-60 | 26,223 % |
| Ni-61 | 1,140 % |
| Ni-62 | 3,634 % |
| Ni-64 | 0,926 % |
Man muss deren Atommassen mit den Prozentzahlen gewichten und kommt deshalb auf einen niedrigeren Wert für die mittlere Gesamt-Atommasse als beim Co.
Die Massen eines Isotops berechnen sich übrigens nicht dadurch, dass man einfach die Massen von Protonen und von Neutronen sowie der Elektronen addiert. Bei deren Zusammenschluss kommt es zu einem Energieverlust, der sich als „Massedefekt“ äußert.
Grund für die Nickel-58-Häufung: Die Kernbindungsenergie aller Elemente hat bei 26Eisen-56 bis 27Cobalt-59 ihr Maximum. Bis zu diesem Kern wird bei seiner Bildung Energie frei, danach muss Energie aufgewendet werden – wie zum Beispiel in einer Supernova. Aus diesem Grunde ist Ni-58 am häufigsten unter den Ni-Isotopen. Dass Ni-59 nicht auftaucht, hat energetische Gründe, die man in der Physik des Atomkerns suchen muss.
Wir erinnern bei dem Problem, dass Sie aufgeworfen haben, an die Geschichte der Chemie: Anders als zunächst angenommen eignen sich Atommassen nicht als Grundlage für die Ordnung der Elemente in einem PSE.
1423
F: Ich bin Student an der TU-Berlin und absolviere derzeit ein Praktikum in Chile. Bei
meinen Arbeiten hier bin ich auf ein Problem gestoßen, was ich mit den hier zur Verfügung stehenden Mittel nicht mehr lösen kann.
Zudem fällt es mir als angehender Maschinenbauer nicht gerade leicht chemisch komplizierte Reaktionen nachzuvollziehen. Daher
wende ich mich an Sie mit der Hoffnung eine Antwort zu erhalten.
Es wird versucht bei einer großen Wäscherei eine Anlage zu installieren, die Ozon in verschiedenen Konzentrationen in das
Waschwasser einleitet. Dadurch wird es ermöglicht den Waschprozess bei einer sehr geringen Wassertemperatur ablaufen zu lassen.
Die Vorteile liegen auf der Hand.
Leider erschließt sich mir aber nicht der chemische Reaktionsablauf. Da diese Thematik auch für Europa sehr innovativ und neu
ist, finde ich kaum Informationen darüber. Es wäre mir eine sehr große Hilfe, wenn Sie mir eine ungefähre Vorstellung über die
Reaktionsgleichungen von Waschmittel, Wasser und Ozon geben könnten.
A: Ozon wird in Europa vielleicht nicht zum Verstärken der Wirkung von Waschmitteln
benutzt, aber zur Wasserreinigung schon lange! So z. B. auch zur Desinfektion von Schwimmbad-Wasser. In Waschmitteln dagegen
nutzt man lieber stabile, in Lösung jedoch Peroxid-entwickelnde Verbindungen wie Peroxocarbonate. Hier spielt vor allem die
Freisetzung von atomarem Sauerstoff die Hauptrolle.
Ozon reagiert mit Wasser zu Radikalen wie Hydroxyl HO• sowie Hydroperoxid HOO•, die stark oxidierend wirken.
Das Waschmittel spielt dabei nur die bekannte Rolle: Beseitigung des anfallenden Schmutzes durch die emulgierende
Wirkung seiner Tenside.
Lesen Sie hier. Auch in den anderen Webseiten zum Thema
Ozon finden Sie Hinweise.
1424
F: Betreff: Gefährlichkeit von Pechblende/Uranerzen
Ich besitze eine etwa 6kg schwere Pechblende-Stufe. Ich mache mir aber sorgen um die Radioaktivität, und zwar die der
Begleitelemente und um das freiwerdende Radon. (Der Hauptbestandteil Uran soll ja wegen alpha-Strahlung bei äußerlichem
Kontakt kaum gefährlich sein.) Ich lagere es im Keller. Ist das gefährlich wegen mangelnder Durchlüftung (Radonbelastung)?
A: Uran selbst ist nicht sonderlich gefährlich. Pechblende ist aber nicht Uran.
Das Mineral ist wesentlich gefährlicher als das Uran, denn dieses Uranerz enthält alle Folgenuklide der Uranzerfallsketten
und zeigt damit eine wesentlich höhere Strahlungsaktivität als Uran. Sie sprechen ja selbst das Radon an; dazu gehören aber
Radium, Polonium (usw.). In schlecht durchlüfteten Kellern dürfte das Lagern problematisch sein. Es hat ja nach der Wende
Probleme im Erzgebirge gegeben, wo man Hausfundamente mit Steinen von den Abraumhalden der sogenannten Wismut-AG gebaut
hat und wo die Radon-Konzentrationen im Keller deshalb sagenhaft hoch waren. Aber auch Steinplatten in einem
innerstädtischen Bereich mussten ausgetauscht werden (war es Dresden?). Und das war nur gering strahlender
Abraum, also nicht eine reine Pechblende-Stufe, wie Sie sie wohl lagern!
Achten Sie darauf, dass vor allem auch die Berührung des Minerals zu Inkorporationen führen kann. Folgen: Neben der chemischen Vergiftung durch Schwermetalle kommt als vielfach Schlimmeres die Kontamination mit strahlendem Material hinzu, das kaum ausgeschieden wird. Das gilt vor allem auch für den unsichtbaren Staub, der bei jeder Bewegung der Stufe unvermeidbar ist. Denken Sie an die Poloniumvergiftung, über die vor einiger Zeit in den Medien ausführlich berichtet wurde.
Ich würde die Stufe (wenn überhaupt) in einem gelüfteten Raum – wie Gartenhaus oder Garage – lagern. Auf keinen Fall dürfen Kinder damit Kontakt bekommen.
Besser noch sollten Sie die Stufe fachmännisch entsorgen lassen. Denn so attraktiv ist das Mineral meines Wissens nach nicht, dass sich das gesundheitliche Risiko lohnte.
1425
F: Ich bin begeisterte Chemielehrerin. Seit einigen Wochen leide ich an einigen
widerlichen Allergien, die meine Augen verquellen lassen und an sehr unangenehmen Körperstellen Ekzeme bilden. Eine dieser
Allergien ist gegen Paraphenylendiamin, das leider allgegenwärtig ist - und natürlich nicht deklariert. Die Allergologin
sagte, ich solle sämtliche schwarzen und blauen Kleidungsstücke, einschließlich der Schuhe abschaffen, um sicher zu gehen.
Aber auch in Druckerzeugnissen, gefärbten Kunststoffen, Fahrradgriffen usw. kann es enthalten sein.
Ich möchte gerne mit einigen Kleidungsstücken, Druckerfarbe und Leder Nachweise auf PPD machen, habe aber bisher noch nichts
gefunden. Vielleicht gibt es ja auch genauere Aussagen, bei welchen Materialien ich vorsichtig sein muss und bei welchen der
Stoff garnicht verwendet wird. Ein anderes Problem können Azofarbstoffe sein, für die es Kreuzallergien mit PPD gibt. Ich habe
z.B. beobachtet, dass schlimmere Reaktionen vorkommen, wenn ich stark schwitze. Offenbar löst oder spaltet der Schweiß PPD
aus dem Farbstoff.
Ich wäre sehr froh, wenn Sie mir Tipps zu einem Nachweis geben könnten oder auch andere Hinweise.
A: Sie haben recht: Allergenes para-Phenylendiamin (PPD) ist potentiell überall
vorhanden: Als Monomeres von Kunststoffen wie Kevlar (Aramid) oder als Komponente von
Azo-Farbstoffen. Es gibt aber auch m- und p-Phenylendiamine sowie N-substituierte. Sie sind übrigens auch als Zusätze zu
kosmetischen Artikeln zugelassen! Auf ihnen soll die Allergie vieler Friseure beruhen. N-substituierte PPDs sind als
Farbkuppler in Farbfilmentwicklern bekannt.
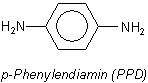
Nachweise auf PPD werden Ihnen ohne aufwendige Anreicherungsprozeduren und teure Apparatetechnik nicht gelingen. Ein allergenes Potential kann sich schon aufgrund von Spuren aufbauen. Hinzu kommt, dass sich das PPD in den meisten Fällen erst beim Gebrauch des Kleidungsstücks (usw.) bildet – durch bakterielle reduktive Tätigkeit. Bakterien übertragen nämlich Wasserstoff auf Azo-Farbstoffe, spalten diese und setzen dabei Phenylendiamine überhaupt erst frei. Ähnliches gilt ja für Kongorot, bei dem Benzidin entsteht.
Damit wird deutlich, wie Sie an Ihr gesundheitliches Problem herangehen müssen: Sie sollten nicht nur entsprechend Gefärbtes vermeiden, sondern auch dazu noch eine Körperhygiene betreiben, die vielleicht übertrieben anmutet. Hinzu kommt, dass Sie nichts Enges tragen dürfen, damit sich darunter kein Schweiß bilden kann. Sagenhaft sind die Jogginghosen oder die Fahrradhosen, die aus für mich völlig unerfindlichen Gründen ganz eng anliegend getragen werden. Hinzu kommt der sparsame Umgang mit Kosmetika und vor allem mit Haarfärbemitteln.
Sie müssen deshalb nicht wie eine graue Maus daher kommen. Aber auf allzu schrilles Outfit und vor allem auf Klamotten aus Dritte-Welt-Ländern (wozu ich in diesem Fall auch Mittelmeerländer zähle) sollten Sie verzichten.
Ich empfehle ein Gespräch mit den Chemikern eines Chemischen Untersuchungsamts. Die können Ihnen vielleicht helfen.