 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1436
F: Ich habe einige Fragen zur "Acroleinentstehung bei Glycerinschwelung".
Seit einigen Jahren gibt es ein Gesetz nach dem der Feuchtigkeitsgehalt bei Wasserpfeifentabaken höchstens 5%
betragen darf. Grund dafür ist die Annahme, dass bei der Verbrennung, wobei es sich bei der Wasserpfeife meines
Wissens eher um eine Verdunstung oder Verschwelung, von Glycerin, das in den Tabaken verwendet wird, Acrolein
entsteht, das im Verdacht steht krebserregend zu sein. Viele Jugendliche vermischen den Tabak mit Glycerin
oder kaufen sich Glycerin-Mix um den Tabak zu befeuchten (Rauchentstehung).Ich bin in der 11. Klasse und
interessiere mich sehr für Chemie und habe mich deswegen schon seit einigen Wochen intensiv mit dem Thema
befasst. Man kann sagen, dass ich nach 3 Wochen Infosuche eigentlich kein Stück weiter gekommen bin,
worüber ich etwas enttäuscht bin (außer, dass Acrolein entsteht).
Meine Fragen wären nun: Ist die entstehende Menge A. gefählich für den Menschen, da ich gelesen habe man
würde die Entstehung durch stechenden Geruch mitbekommen? Wie viel A. wird gefiltert, durch Wasser etc? Aus
was besteht der Shisharauch (es wird diskutiert über Wasserdampf, CO, CO2 usw.)? Gäbe es eine Möglichkeit
das entstehende A. durch eine chemische Reaktion zu einem Stoff reagieren zu lassen der nicht schädlich ist.
Vielleicht gibt es ja sogar eine ganz einfache Möglichkeit wie die Zugabe einer Substanz in das Wasser, an
die das A. gebunden wird(was ich allerdings kaum glaube...irgendjemand wäre sicher schon auf die Idee gekommen=))
Welche Möglichkeiten gäbe es noch den Tabak anzufeuchten ohne Glycerin zu verwenden? In einigen Foren ist auch
zu lesen, dass Honig verwendet wird, wobei aber anscheinend giftige Dämpfe entstehen sollen (Karamelisierung?).
Ich weiß natürlich, dass Rauchen NIE gesund ist, aber wenn man z.B. Acrolein vermeiden könnte, wäre das schonmal
super!
Viele Berichte und Untersuchungsergebnisse sind nicht unbedingt ernst zu nehmen da man die Jugendlichen vom Rauchen (Shisharauchen) abhalten will. Ich habe mich an Sie gewendet, da ich hoffe von Ihnen eine ehrliche Meinung zu bekommen.
Ich würde mich über eine Antwort wirklich sehr freuen!
A: Ihre Anfrage zielt wohl eher dahin, wie Sie für sich das momentan
moderne Wasserpfeifenrauchen „retten“ können. Ich kenne das Zeugs aus verschiedenen Aufenthalten in orientalischen
Ländern und habe es selbst probiert.
Das Wasserpfeifenrauchen täuscht nur gesundes Genießen vor, ist aber genau so schlimm wie das Paffen einer Zigarette. Sie rauchen sogar noch mehr. In der Türkei gibt man Ihnen einen ziemlichen Brocken Tabak – vielleicht der Tabakmenge von 5-10 Zigaretten entsprechend - und legt Ihnen das auf die Schale mit der glühenden Holzkohle. Man pafft solange, bis alles weg ist. Man muss oft genug die Holzkohle, die man zum Glühen auflegt, erneuern.
Machen wir eine Schadstoffbilanz: Es gibt keinen Unterschied zum Zigarettenrauchen. Hinzu kommen die Abgase der glühenden Kohlestückchen, die Sie auf den Tabak packen. Und dann der Feuchthalter Glycerin, aus dem beim Verschwelen Acrolein entsteht. Alles zusammen ist ein brisantes Gemisch, das unendlich viele Schadstoffe produziert. Davon werden nur wenige durch das Wasser zurückgehalten. Acrolein zum Beispiel ist schwerlöslich in Wasser. Es gibt zwar chemische „Filter“, die das Acrolein adsorptiv aus dem Rauch entfernen könnten. Mit denen werden aber auch die meisten anderen „Genussstoffe“ zurückgehalten.
Acrolein ist eine äußerst reaktive Form der Acrylverbindungen, die fast allesamt das Gefahrensymbol (T) tragen. Es ist darüber hinaus ein Schadstoff, der im Verdacht steht, Krebs auszulösen. Deshalb gibt es meines Wissens keinen MAK-Wert. Jedes Molekül, das Sie aufnehmen, kann zum Auslöser von Krebs werden.
Natürlich gibt es eine Reihe von Substanzen, die wie Glycerin hygroskopisch sind und den Tabak feucht halten. Aber sie bilden beim Verglühen letztlich ähnliche ungesättigte, kanzerogene Verbindungen.
Ich meine, Sie sollten das Rauchen gar nicht erst anfangen. Oder Sie sollten es einfach lassen, wenn Sie schon rauchen. Nehmen Sie auch die Berichte über Acrolein ernst. Sie haben Recht, wenn diese u. a. dazu dienen sollen, Ihnen das Rauchen abzugewöhnen… Ist das schlimm? Für das Geld, was Sie als Elfklässler verpaffen, können Sie sich in ein paar Jahren locker ein Studium leisten. Nehmen Sie diesen momentanen Trend zum Wasserpfeifenrauchen nur als das, was es ist: Eine modische Eintagsfliege…
1437
F: Obwohl ich kurz davor stehe, mein Chemie-Studium zu beenden, stellt sich
mir bei der Revision eines simplen chemischen Sachverhaltes des Grundstudiums ein bis dato nicht lösbares Problem:
Das Objekt meiner Frage sind die Ionenwanderungstendenzen innerhalb eines galvanischen Elementes: Die gängigen
Lehrbuchdarstellungen stimmen darin überein, dass der durch den metallischen Leiter (Draht) ermöglichte Fluss der
Elektronen von der Anode zur Kathode außerhalb der Halbzellen durch einen ihm entgegengesetzten Fluss der Anionen
aus dem Kathoden- in den Anodenraum kompensiert wird. Dies erscheint mir logisch, wird doch auf diese Weise der
Stromkreis ,hier verstanden als zyklischer Transport negativer Ladungen, geschlossen.
Allerdings sollen, und dies wird mir bei genauerem Überlegen immer unklarer, die gebildeten Kationen des Anodenraumes
eine Wanderung in den Kathodenraum antreten - ein Verhalten, das zwar auf den ersten Blick logisch erscheint (Anionen zur
Anode, Kationen zur Kathode), auf den zweiten Blick aber stutzig macht:
Wird nicht der negative Ladungsüberschuss des Kathodenraumes durch die Abwanderung der Anionen bereits kompensiert
und hierbei gleichzeitig der positive Ladungsüberschuss des Anodenraumes aufgehoben? Genügt es nicht vollauf, einzig
einen Fluss der Anionen durch das Diaphragma vom Kathoden- in den Anodenraum anzunehmen?
Wandern die Kationen gleichzeitig und gegenläufig, bietet sich mir ein paradoxes Bild: In gängigen Darstellungen des
Daniell-Elementes (Mortimer, Atkins, etc.) werden zwischen den Elektronenräumen stets positive und negative Ladungsträger
ausgetauscht, um hiermit den theoretisch plausiblen Ladungsausgleich zu schaffen. Doch ist der Effekt ein gegenteiliger:
Postuliert man innerhalb eines Zeitintervalls die gleichzeitige gegenläufige Wanderung gleich hoch geladener positiver
wie negativer Ladungsträger, trägt man hiermit letztlich zu einer elektrostatischen Aufladung der betrachteten
Halbzelleninnenräume bei, anstatt dies abzubauen.
Eine solche statische Aufladung der Lösungen kann beispielsweise in der folgenden populären Computersimulation nachvollzogen
werden, die sich unter folgendem Link findet (Animation ganz unten auf der Seite):
http://www.chempage.de/theorie/galvanischezelle.htm
Zählen Sie mal nach: Nach Ablaufen einer vollständigen "Elektronentransaktion" ist der Anodenraum 4-fach negativ geladen und der Kathodenraum entsprechend 4-fach positiv!?
Vielleicht können Sie mir bei meinem Problem mit der "chemischen Bagatelle" im Rahmen des galvanischen Elementes aus meiner Verwirrung helfen. Ich wäre dankbar.
A: Sie beschreiben alles richtig: Es wandern nur die negativen Ladungen. Die
positiven Ladungen wandern nicht. Das geht nicht. Diese entstehen ja gerade an der Anode. Ihre Ladung, die zu einer
Elektroden-Polarisation führen würde, wird durch die hinzu kommenden Anionen kompensiert.
Ich habe mir das von Ihnen angesprochene Bild des Daniell-Elements im Mortimer angesehen. Es ist didaktisch nicht
in Ordnung. Denn es wurden zwei Sulfat-Ionen gezeichnet. Natürlich darf nur eines gezeichnet werden, und das sollte gerade
die poröse Trennwand in Richtung auf das eben gebildete Zink-Ion durchdringen.
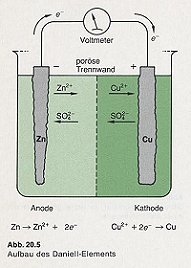
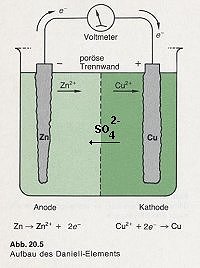
Korrektur eines Bildes: Links das Original; rechts unser Verbesserungsvorschlag…
Bildquelle: Mortimer: Chemie-Basiswissen. Thieme, Stuttgart 1987; Seite 328
Was Sie hinsichtlich der Animation sagen, stimmt ebenfalls: Die letzten beiden wandernden Zink-Ionen stören die Bilanz. Die sollen vielleicht der Tatsache Rechnung tragen, dass immer einige Zink-Ionen in den Kathodenraum gelangen. Wenn man das aber so zeigt, sollte man auch entsprechend die Sulfat-Ionen berücksichtigen.
1438
F: Ihre spektakuläre Schilderung des "chemischen Flammenwerfers" (tip/07_01.htm)
erinnert mich an ein Experiment, das ich mit ca. 12 Jahren machte:
Eine benachbarte Werkstatt verarbeitete Elektron (hochmagnesiumhaltige Leichtmetalllegierung), und Kollegen und ich haben die Drehspäne, die im Freien in einer Mulde gelagert waren, jeweils sackweise mitgenommen. Dass das Zeug gut brennt und Vorsicht angeraten war, wussten wir, aber es gab schon interessante Effekte. Stopfte man die Späne ziemlich dicht in eine leere Konservendose, ließ einen Span raushängen und zündete man damit den Inhalt an, gabs ein ziemlich bescheidenes Feuer, wohl, weil in der schlanken, nur zu etwa 1/4 gefüllten Dose (ex Wiener Würstchen) kaum Sauerstoff nachströmte.
Dann ein Schuss Wasser aus einem Spritzkännchen mit langem Rohr, und hoppla! eine Stichflamme, ca. ein halber bis 1 m hoch, schießt aus der Dose. Von da an verstand jeder, dass Magnesiumbrände nicht mit Wasser, sondern z. B. mit (trockenem!!) Sand zu löschen sind.
Bei den Pfadfindern wurde das Zeug als Anzündhilfe beliebt ... je nasser, desto besser.
Was geht bei diesem Effekt genau ab? Pyrolyse des Wasser, explosionsartiges Abbrennen des Wasserstoffs mit Luftsauerstoff außerhalb und ruhigeres Abbrennen von Magnesium und Pyrolyse-Sauerstoff innerhalb der Dose? Oder nur heftiges Aufmischen der Atmosphäre in der Dose?
Ich bin Maschinenbauer, arbeite aber als Tribologe mit Schwergewicht auf Schmierstoffen, da habe ich recht viel mit Chemie zu tun. Ihre Seiten zur Erdölchemie habe ich natürlich mit Haut und Haar gefressen.
A: Danke für die Mail. Bei Ihrem Versuch (Wasser mischen mit heißem Metall) findet
eine Reaktion zwischen Wasser und Magnesium statt. Die Oxidationswärme des Magnesiums ist so groß, dass sie ausreicht, dem
anscheinend so stabilen Wasser den gebundenen Sauerstoff zu entreißen:
H2O + Mg ———> MgO + H2
Der Wasserstoff bildet mit dem Sauerstoff der Luft Knallgas, welches explodiert bzw. zusätzlich abbrennt.
Wir haben dazu eine Webseite.
Der Versuch geht übrigens auch mit glühendem Eisen. So hat Lavoisier nachgewiesen, dass Wasser kein Element, sondern ein
zusammengesetzter Stoff (also eine Verbindung) ist.
Klicken Sie hier.
1439
F: Rostet ein Magnet????
Mein Sohn stellte mir die Frage warum rostet ein Magnet nicht, haben Sie eine Antwort darauf?
A: Es gibt eine Vielzahl von Magnetarten. Die sind überhaupt nicht alle aus Eisen.
Letztere sind inzwischen sogar selten geworden.
Anders als Ihr Sohn meint, rosten die klassischen Magneten aus weichem Eisen ganz kräftig, wenn sie in einer Umgebung
liegen, die das Rosten („Korrosion“) fördert: Feuchtigkeit, Luftsauerstoff und Salz oder Säure. Andere Magneten, wie die
in Küchen- oder Badezimmermöbeln, sind oft aus Edelstahl gefertigt und deshalb weniger anfällig. Aber auch die modernen,
welche Legierungen mit so exotischen ferromagnetischen Metallen wie Gadolinium, Neodym,
Samarium usw. enthalten, sind rostanfällig.
Nicht durch Rost angegriffen werden Magneten, die von vornherein aus Oxiden von Metallen wie Cobalt bestehen. Denn Rosten
bedeutet ja Oxidbildung. Diese Magneten sind im Allgemeinen aber recht schlagempfindlich, das heißt, sie bröckeln leicht.
1440
F: Hallo Herr Blume,
mein name ist … und ich habe eine frage.nein eigentlich zwei. ich bin in der 9 klasse im gymi und muss ein referat über
reinigungsmitel halten.bitte helfen sie mir.
also wie löst ein kalklöser kalk auf?
UND: Wie funktioniert ein Rohrreiniger? irgendwas mit natronlauge ?
Über tenside und so habe ich schon einige dinge erfahren...
es wäre sehr freundlich wenn sie mir eine kleine hilfe geben würden.
A: Mit Kalkreiniger meinst du wahrscheinlich Kalkentferner,
Entkalker (usw.). Diese Reiniger enthalten Säuren, die Kalkablagerungen zersetzen und in wasserlösliche Salze umwandeln.
Kalk ist bekanntlich Calciumcarbonat und schwer löslich. Hier ist die Reaktionsgleichung für seine Zersetzung mit Salzsäure.
CaCO3 (unlöslich) + 2 HCl ———> CaCl2 (leichtlöslich) + H2O + CO2 (gasförmig)
Das kannst du im Labor selbst nachprüfen.
In Entkalkern ist natürlich keine Salzsäure enthalten; man nimmt stattdessen die schwächere Essigsäure und auch die Citronensäure. Das ist aber eine Frage der Oberflächen, die du entkalken willst. Mit Essigsäure greifst du zum Beispiel Chrom an. Da nimmst du besser Citronensäure.
Bei Rohrreinigern (Abflussreiniger) handelt es sich letztlich um äußerst aggressive Laugen wie flüssiger Kalilauge bzw. dem festen Ätzkali (Formel KOH). Sie beruhen darauf, dass sie Fette und Haare zersetzen und damit die Hauptursachen für die Verstopfung von Badezimmer-Rohrleitungen beseitigen. Sie greifen aber auch das Porzellan der Waschbecken oder Kloschüsseln an. Zur genauen Zusammensetzung und Funktion der Rohrreiniger lies hier.