 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1526
F: Ich habe mich auf Ihrer sehr interessanten Internetseite ein wenig zum Thema Citronensäure
belesen. Leider habe ich das gesuchte nicht gefunden und wende mich deshalb mit dieser Frage an Sie.
Ich habe ein ca. 55 Jahre altes Taschenmesser erworben, welches zwar unbenutzt aber trotzdem leicht verrostet war. Um es zu entrosten
hatte ich die Idee Citronensäure zu benutzen, da ich davon schon häufig im Internet gelesen habe. Ich habe mir also in einem Drogeriemarkt
trockene Citronensäure (17g) gekauft und diese in ca. 1l warmen Wasser (50-60°C)aufgelöst. Dann habe ich das Messer darin eingelegt. Nach
ca. 30min habe ich es aus der Lösung entnommen, und gründlich mit Wasser abgespült - der Rost war verschwunden. Als nächstes habe ich
festgestellt, dass sich der Stahl größtenteils schwarz eingefärbt hat. An manchen Stellen etwas mehr, an anderen weniger. Was für eine
Reaktion ist das?
Meine weitere Feststellung folgte beim Zuklappen des Messers. Es machte auf einmal "KLICK" und die Feder, welche die Klinge hält, war
gebrochen. Das gleiche passierte dann auch noch mit der Feder des Büchsenöffners. Kann das mit der Citronensäure zusammenhängen? Kann diese
tatsächlich einen Stahl in so kurzer Zeit so stark verspröden lassen? Oder ist eher davon auszugehen, dass das Brechen der Federn auch
ohne die Citronensäure eingetreten wäre?
A: Stahl enthält bekanntlich Kohlenstoff.
Dieser wird beim Rosten freigesetzt, weil er nicht angegriffen wird. Wenn der Rost entfernt wird, bleibt der Kohlenstoff als schwarzer
Belag zurück. Den Kohlenstoff bekommen Sie auch, wenn Sie z. B. eine Rasierklinge in Salzsäure zersetzen.
Zu der Feder: Dass die bricht, liegt einfach daran, dass auch sie zum Teil vom Rost zerfressen war und dem Druck beim Zuklappen des Messers nicht mehr standhielt. Auf keinen Fall ist die Citronensäure als Ursache zu sehen.
1527
F: Herr: es ist Zeit. Der Sommer war sehr groß.
Nun lass den Wind durch bunte Blätter wehen.
Da bleibt der Chemiker verwundert stehen:
"Das Herbstlaub - wonach riecht es bloß?"
Können Sie mir da weiterhelfen? Welche Substanzen sind für den typischen Geruch der trockenen abgefallenen Blätter verantwortlich?
A: Ja, wonach riecht Laub überhaupt? Wie dieses Parfüm: „Es besticht durch seinen leicht
holzigen Duft, der an Herbstlaub erinnert“? Ich habe einen Mikrobiologen (Dr. Mathias Keller) gefragt. Er meint:
Vielleicht wird der Geruch von Zersetzungsprodukten von Blattinhaltsstoffen (unter anderem von Flavonoiden) verursacht, die durch Pilze und Bakterien abgebaut werden. Vielleicht ist es aber auch der "erdige" Geruch des Waldbodens. Der geht auf die Stoffwechselaktivität von Streptomyceten zurück. Diese (und andere Mikroorganismen) produzieren eine bizyklische Verbindung, Geosmin.
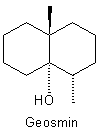
Von diesem Stoff gibt es zwei Enantiomere, also optische Isomere. Das natürlich vorkommende Enantiomer ist (-)-Geosmin.
Dieser Stoff riecht ganz typisch nach „Walderde“. Erstaunlich ist die geringe Geruchsschwelle: 0,1 ppb. Das bedeutet: Wir können ein Geosmin-Molekül unter 10 Milliarden Luftmolekülen „erschnuppern“.
Es gibt noch eine ähnliche Substanz, deren Geruchsschwelle in der gleichen Größenordnung liegt, bei 10 ng/L oder kg Medium (Wasser, Lebensmittel oder Luft): 2-Methylisoborneol. Auch hiervon gibt es zwei Enantiomere. Die gelegentlich auch als muffig oder gammelig riechend beschriebene Verbindung ist das (S)-(-)-Isomere.
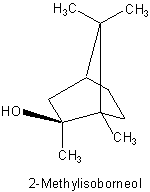
Man erkennt durchaus strukturelle Ähnlichkeiten zwischen dem Methylisobornelol und dem Geosmin.
Auch diese Substanz wird von Streptomyceten synthetisiert.
Streptomyceten sind aerobe Mikroorganismen. Sie gehören zu den Gram-positiven Bakterien und wachsen mycel-artig; daher wurden sie früher zu den Pilzen gerechnet. Man kann Streptomyceten leicht aus dem Waldboden isolieren, da sie ubiquitär sind. Es ist denkbar, dass sie auch an der Geruchsbildung des Laubs beteiligt sind.
Streptomyceten werden vor allem wegen ihrer Fähigkeit, Antibiotika und andere wertvolle Sekundärmetaboliten synthetisieren zu können, genau untersucht.
1528
F: Könnten Sie mir bitte das Zustandekommen des +I-Effekts erklären?
In "Chemie im Kontext" wird auf S. 291 definiert: + I-Effekt wenn EN(R) kleiner EN(H). Ein + I-Effekt wird z.B. von einer Alkylgruppe
ausgeübt, die EN(C) ist jedoch größer als diejenige von H.
A: Leider besitze ich das Buch nicht, so dass mir der Kontext zu Ihrer Frage fehlt… Wenn es
sich um organisch-chemische Verbindungen handelt, meine ich, dass die Leute statt EN(H) in Wirklichkeit EN(C) meinten.
Ich gehe mal von folgender gültigen Definition aus:
Der I-Effekt hat seine Ursache in den unterschiedlichen EN-Werten der Atome in einer polaren Atombindung. Wir betrachten eine Verbindung
H3C-R
Ist EN(R) < EN(C), so werden Elektronen vom betrachteten C-Atom angezogen. Wir haben einen +I-Effekt.
Verwirrend: Das C-Atom bekommt das Symbol d-.
Beispiel R = Li; EN(Li) = 0,97 und EN(C) = 2,50
H3C<-Li
Weitere Beispiele: Metallatome, in Bezug auf die Methylgruppe t-Alkylgruppen…
Ist EN(R) > EN(C), so werden Elektronen vom betrachteten C-Atom abgezogen. Wir haben einen -I-Effekt.
Verwirrend: Das C-Atom bekommt das Symbol d+.
Beispiel R = Cl; EN(Cl) = 2,83 und EN(C) = 2,50
H3C->Cl
Weitere Beispiele: Halogenatome, Hydroxylgruppe, Nitrogruppe…
1529
F: Wie reagieren die elementaren Lanthanoid-Metalle mit Alkalihydroxiden? Reagieren sie überhaupt?
Oder lösen sie sich wie Aluminium darin auf?
Trotz Recherchen im Internet, Holleman/Wiberg, etc. habe ich leider keine Antwort darauf gefunden.
A: Zunächst eine kleine Anmerkung: Aluminium löst sich nicht in Laugen auf (das
wäre ein leicht reversibler physikalischer Vorgang), sondern es zersetzt sich in ihnen (chemischer Vorgang)…
Der Grund für die Zersetzung von Aluminium in Laugen: Es bildet sich zwar formal zunächst schwerlösliches Aluminiumhydroxid. Das reagiert dann im Überschuss von Lauge zu löslichen Aluminat-Komplexen weiter. Dadurch wird die Passivierung durch Hydroxidbildung verhindert.
Al + 3 H2O ———> Al(OH)3 (schwerlöslich) + 3/2 H2
Al(OH)3 (schwerlöslich) + 3 OH- ———> [Al(OH)6]3- (gelöst)
Ursache: Aluminium ist amphoter.
Auch die Lanthanoide (chem. Symbol: Ln) bilden als besonders unedle Metalle mit dem Wasseranteil der Laugen Hydroxide.
Ln + 3 H2O ———> Ln(OH)3 (schwerlöslich) + 3/2 H2
Allerdings gibt es einen Unterschied zu Aluminium: Der Hydroxidüberzug unterbindet wegen seiner Schwerlöslichkeit den weiteren Angriff auf das Metall (-> Passivierung). Denn Lanthanoide sind nicht amphoter; überschüssige Lauge führt deshalb nicht zur Zersetzung des Hydroxids.
Ausnahmen sind Yb und Lu, die allerdings aber nur unter heftigsten Bedingungen (hoher Druck, hohe Konzentration an Lauge) reagieren.
Sie können das unterschiedliche Verhalten von Al und Ln im chemischen Experiment zeigen: Vergleichen Sie die Reaktionen, die bei der Einwirkung von Natronlauge auf eine Lösung von Al-Salzen und von Lanthanoid-Salzen eintreten. In beiden Fällen gibt es zunächst einen farblosen Niederschlag, der sich nur beim Al mit weiterer Zugabe von Natronlauge wieder zersetzt („auflöst“).
1530
F: Das Gerede wegen der Rauchverbots geht mir langsam auf die Nerven. Da soll in den Kneipen nicht
mehr geraucht werden, weil darunter die Gesundheit der Gäste leiden soll. Aber der Alkoholkonsum in den Kneipen ist doch genau so schädigend.
A: Für den Einzelnen stimmt das, was Sie sagen. Bedenken Sie aber:
| - | Wer trinkt, schädigt nur sich selbst. |
| - | Wer raucht, verbreitet sein Gift um sich herum und trifft damit auch die Nachbarn, die so genannten Passivraucher. Die haben aufgrund ihres nicht angepassten Stoffwechsels ein höheres Krebsrisiko als die Raucher. Hierzu gibt es eindeutige Forschungsergebnisse. Das betrifft zum Beispiel die Aromatenentgiftung. Außerdem müssen wir an die Hemmwirkung des im Zigarettenrauchs reichlich vorhandenen Schwermetalls Cadmium auf die Reparatur-Enzyme der DNA denken („Dismatch-Enzyme“). Hinzu kommen Kreislaufprobleme aufgrund der gefäßverengenden Nicotinwirkung. Und so weiter. |
Bei der Diskussion um das Rauchverbot für Kneipen und Restaurants hat man den Eindruck, dass es den Wirten ausschließlich um ihren wirtschaftlichen Vorteil geht.
Hier jedoch geht es um ganz andere, uns alle betreffende Wirtschaftsgüter: Es geht um die Gesundheit der Passivraucher oder meinetwegen auch der Angestellten. Und wenn man die gesundheitlichen Folgekosten des Rauchens in Betracht zieht, zahlen die Nichtraucher doppelt. Naja – das deutsche Bruttosozialprodukt wird mit jedem Krebsfall gesteigert. Das ist so wie bei einem Verkehrsunfall…
Ein Tipp: Diejenigen, die soviel Energie in Pro-Raucher-Kampagnen stecken, sollten diesen ihren Aufwand eher nutzen, um sich das Rauchen abzugewöhnen…