 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1591
F: Betreff: Oxidation von Tartrat mit Co-Katalysator
Ich habe kein Glück gehabt (im Internet) eine ausführlichere Erklärung zur Stuktur des Dicobalt-Tartrat aktivierten Komplexes, die bei Ihnen schematisch unter dem Absatz "Katalytische Wirkung von Cobaltsalzen" zu finden ist, zu finden. Könnten Sie mich bitte an eine Quelle führen? Ich verstehe die abgebildete Struktur nicht ganz.
A: Sie meinen die Webseite. Leider habe
ich keine Literaturstelle dazu. Ich habe es auf einer Tagung von einem niederländischen Chemiker erfahren. Hier ist noch
einmal das Bild, das Sie ansprechen.
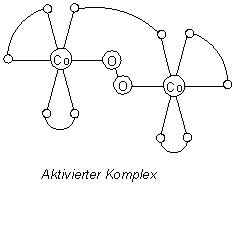
Im schematischen Bild erkennen Sie insgesamt fünf Weinsäuremoleküle und ein Molekül Wasserstoffperoxid, die an zwei Cobalt-Ionen gebunden sind.
Cobalt ist als d-Element ein guter Komplexbildner, Wasserstoffperoxid und Weinsäure sind entsprechend gut bindende Liganden. So bindet Co2+ beide simultan und sorgt…
a) für sterisch exakte, gegenseitige Ausrichtung von den beiden Substraten und Katalysator und…
b) für den Elektronentransfer vom Reduktionsmittel Weinsäure zum Oxidationsmittel H2O2.
Sie können das System deshalb durchaus auch als Modell für die Wirkung von Metall-Ionen in den aktiven Zentren von Metallo-Enzymen „verkaufen“.
1592
F: Im Chemie-Unterricht hatten wir letztens das Thema „galvanisches Element“. Dazu hat
sich mir die Frage aufgedrängt, wozu man in der Donator-Halbzelle eine Lösung der Ionen des Elektrodenmaterials benötigt. Z.B.
wird ja beim Daniell-Element eine Zinkelektrode in eine Zn2+ -Lösung getaucht:
An der Elektrode der Donator-Halbzelle findet folgende Reaktion statt: Zn (s) ↔ Zn2+ (aq) + 2e-
Daher müsste doch die Hinreaktion begünstigt werden, wenn zu Beginn möglichst wenig, also gar keine, Zink-Ionen vorlägen.
D.h., wenn die Zinkelektrode in destilliertes Wasser getaucht würde, so würde doch die Ansammlung von Elektronen in der Elektrode
begünstigt, dadurch die Spannung zwischen den Halbzellen vergrößert.
A: Sie benötigen auf jeden Fall einen ionischen Elektrolyten in der Donator-Halbzelle,
damit der elektrische Stromkreis geschlossen wird. Denn wenn über den äußeren metallischen Leiter Elektronen zur Akzeptor-Halbzelle
(Kupfer) fließen, fließen durch das Diaphragma entsprechend viele Sulfat-Ionen zum Zink. Natriumsulfat würde reichen.
Wenn Sie jedoch von vornherein ZnSO4-Lösung zur Zinkelektrode geben, stellt sich das chemische Redox-Gleichgewicht Zn <——> Zn2+ rascher ein. Das gilt dann auch für das gewünschte Potential.
Ein weiterer Grund liegt darin, dass Sie in beiden Elektrodenräumen gleiche Konzentrationen von ähnlichen Ionen (Sulfat-Ionen und zweiwertige Kationen) haben sollten. Denn sonst baut sich links und rechts vom Diaphragma ein innerer Widerstand auf, der die Potentialdifferenz zwischen Donator- und Akzeptor-Halbzellen verkleinert.
1593
F: Im Zusammenhang mit dem Periodensystem habe ich den Begriff „Tetrele“ gehört. Selbst im
Holleman-Wiberg finde ich diesen Begriff nicht. Was ist das für ein Element?
A: Das ist eine Abkürzung von „Tetra-Elemente“. Damit
bezeichnet man die Elemente der vierten Hauptgruppe (lat. tetra, vier). Grund ist, dass der Begriff „Kohlenstoffgruppe“
nicht die Vielfalt der Elemente vom Nichtmetall Kohlenstoff bis zum Schwermetall Blei benennen kann. Gleiches gilt für die Borgruppe
(Triele) und die Stickstoffgruppe (Pentele).
Die Gruppen im PSE bezeichnet man heute so:
Dazu kommen noch die Übergangsmetalle (d-Elemente) und die Inneren Übergangsmetalle (f-Elemente). Die Gruppen der Übergangselemente bezeichnete man früher sogar nur als „Nebengruppen“, was der großen Bedeutung dieser Elemente keinesfalls gerecht wird.
1594
F: Warum sind so viele Fische, Seesterne und Korallen rot. Und warum sind andere grün,
blaugrün und blau? Gibt es dafür eine Erklärung?
A: Das Meer ist ab einer Tiefe von ein bis zwei Metern blaugrün, weil dicke Schichten
von Wasser aus dem eingestrahlten weißen Sonnenlicht den roten Anteil absorbieren (Klick hier).
Meerestiere betrachten sozusagen alles durch einen Blaugrün-Filter. In diesem erscheint Rot wie Schwarz, ist also nicht mehr
sichtbar. Man kann auch sagen: Rot und Blaugrün sind Komplementärfarben, die sich gegenseitig auslöschen. Eine perfekte Tarnung!
(Erinnert sei in diesem Zusammenhang an die Rolle eines Gelbfilters bei der Schwarz-Weiß-Fotografie. Er absorbiert Blau. Bei Landschaftsaufnahmen erscheint der Himmel weiß und wolkenlos – wie es seiner Helligkeit entspricht. Wird aber das Blau absorbiert, so erscheint der blaue Bereich des Himmels dunkel, und plötzlich sind all die schönen Wolken zu sehen.)
Und wie ist das mit dem Blau des Hummers oder mancher Seesterne?
Blaugrün ist für Meerestiere das Normlicht. (Unser Normlicht ist Weiß wie das uns umgebende Sonnenlicht.) In blaugrünem Normlicht
wirken blaugrüne Gegenstände nach kurzer Gewöhnungszeit weiß (so wie in unserem Normlicht weiße Gegenstände weiß wirken). Das ist ein
entgegengesetzter Tarnungstrick.
(Erinnert sei hier an eine rotglühende Zigarette in einer schummrig-rot beleuchteten Bar: Die Glut leuchtet weiß!)
Zu den Farben klicke hier.
1595
F: Erst einmal Gratulation zu Ihrer tollen Seite. Jeden Abend kurz vorm Schlafengehen lese ich
mir ein paar Kurze Fragen-Kurze Antworten aus den Email-Gruppen durch. Nicht als Schlafmittel, sondern als Übung versteht sich :-)
Ich finds klasse, wie sie die Sachverhalte immer auf den Punkt bringen, sodass es jeder versteht. Nun muss ich mich auch mal mit
einer Frage an Sie wenden, weil ich im dazu Internet und allen meinen Bücher nix gefunden habe. Im Jander/Blasius steht, dass
Ammonium-Ionen die Fällung von Calciumfluorid verhindern bzw. stören. Auf welche Art und Weise verhindern die Ammonium-Ionen beim
Calciumfluorid die Fällung (Komplexe?, pH-Wert?) und wäre das auch beim Bariumfluorid möglich?
A: Das ist eine Frage des Löslichkeitsprodukts. Zur Ausfällung von schwerlöslichem CaF2
muss eine bestimmte Menge an freien Fluorid-Ionen vorhanden sein. Mit den Protonen, die aus den Ammonium-Ionen stammen, werden die
Fluorid-Ionen eher in die schwache Säure HF (bzw. H2F2) überführt. Damit sinkt die Konzentration an freien F-,
so dass die Fällung sogar ausbleiben kann.
Da bei schwerlöslichen Bariumsalzen das Löslichkeitsprodukt im Allgemeinen immer kleiner ist als das von entsprechenden Calciumsalzen,
ist anzunehmen, dass das auch bei den Fluoriden der Fall ist.