 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1831
F: Wir haben ein ziemlich altes Haus geerbt. Beim Renovieren ist uns aufgefallen,
dass im Dachbereich alle Balken weiß gestrichen worden sind. Was ist das für eine Farbe? Kann die giftig sein?
A: Das kenne ich auch von meinem uralten Elternhaus. Bei den Pigmenten der
weißen Farbe handelt es sich in erster Linie um Produkte, die letztlich auf gebrannten Kalk zurückgehen. Es wurden aber
auch Wasserglas (Natriumsilicat-Lösung) oder andere anorganische Substanzen wie Ammoniumphosphat und alle Salzhydrate
wie Magnesiumchlorid-Heptahydrat (außer den Nitraten…) verwendet. Alle diese Substanzen wurden als wässrige Suspensionen
bzw. Lösungen aufgetragen und sind ungiftig. In der langen Zeit haben sie auch ihre ätzenden Eigenschaften verloren, so
dass Sie also unbesorgt weiterarbeiten können. Da es dabei staubt, sollten Sie allerdings - um Ihre Lungen zu schützen -
einen Atemschutz/Luftfilter tragen.
Beim Weißen der Dachstühle und Dachbodenhölzer handelt es sich um eine Brandschutzmaßnahme, die im 2. Weltkrieg vorgeschrieben
wurde. Als Flammschutzmittel sollten die Pigmente gegen Phosphor- und andere Brandbomben helfen. Als besonders wirksam haben
sie sich allerdings nicht erwiesen.
Ihre Wirkung beruht einmal darauf, dass sie beim Zersetzen Gase wie CO2, Ammoniak und/oder Wasserdampf bilden,
was die Sauerstoffzufuhr unterbrechen sollte. Beim Wasserglas kommt noch der Effekt hinzu, dass es, weil es tief ins Holz
eindringt und dessen Poren schließt, die hitzebedingte Zersetzung von Holz und die daraus resultierende Bildung von brennbaren
Gasen verhindert.
Mit ähnlichen Imprägnaturen behandelt man auch heute noch Streichhölzer, um deren Nachglimmen zu verhindern.
1832
F: Wie haben die Leute früher Löcher in die Steinbeile gebohrt?
A: Obwohl die Beile meistens aus Gneis und damit aus besonders
hartem und zähem mineralischen Material gefertigt wurden, ist das in der Tat gar nicht so schwer - es erfordert nur Zeit.
Die hatte man ja früher ausreichend. Man benötigt feinen Sand und - Stäbe vom Holunderbusch.
Der Steinbeilrohling wird zunächst da etwas angepickelt, wo seine Bohrung sitzen soll. Dann spannt man den Stein ein und setzt darauf einen passenden Hohlstab vom Holunderbusch. Der wird mit einem Bogen, wie man ihn vom Geigenspielen oder Feuermachen her kennt, hin- und herbewegt. Als Schleifmittel verwendet man feinen Sand.
Wie gesagt, es dauert lange, und man benötigt auch eine Menge an Holunderstäben. Aber irgendwann war man durch. Man bohrte übrigens nacheinander von zwei Seiten her. Deshalb sieht man im Beil in der Mitte der Bohrung immer eine Linie. Wie die Leute es schafften, ihre Bohrungen so niederzubringen, dass sie sich in der Mitte trafen, ist deren handwerkliches Geheimnis...
Woher man das alles weiß? Es gibt heute Spezialisten, die machen so etwas. Man spricht von Experimenteller Archäologie.
Das Ganze funktioniert übrigens nicht mit Feuerstein. Der ist bekanntlich so hart, dass man mit ihm Glas ritzen kann. Deshalb sind durchbohrte Feuersteinbeile kaum zu finden. Zur Herstellung von Schlagwerkzeugen befestigte man diese Beile anders: Große Äxte hat man mit Lederriemen am Stab festgebunden. Kleine Äxte dagegen wurden in gebogene Stöcke, gefertigt aus dem besonders zähen Baumstamm-Wurzel-Übergangsbereich, gesteckt. Als „Futter“ für diese Kleinbeile dienten Enden von Hirsch- oder Rentiergeweihen, die ins Holz eingelassen wurden. Die auf diese Art fixierten Kleinbeile konnte man übrigens leicht nachschleifen.
Gneis ist übrigens ein Gestein, das verschiedene silicatische Zusammensetzungen hat. Man beschreibt mit seiner Bezeichnung nur die Genese - vor allem seine Schieferung und mikrokristalline Struktur, die für die bekannte Härte und Zähigkeit sorgt...
Klick mich an!
Steinbeil aus Leopoldshöhe bei Bielefeld (Länge 17,5 cm) (Gefunden von Heinz Möller)
(Foto: Blume)
1833
F1: Ich habe Glycin probiert. Die Substanz schmeckte deutlich sauer. Sie sollte doch süß schmecken.
A1: Zunächst ist Glycin eine Aminosäure, deshalb überrascht
es, dass diese Substanz überhaupt süß schmecken soll, wie der Name schon besagt (griechisch glykys, süß). Glycin hieß früher
Glykokoll, das heißt in etwa: „Der süße Stoff aus dem (Knochen-)Leim (vom griech. kolla; Leim: Das Wort steckt auch
noch im Kollagen; mit dem griechischen gene wird kolla zu „Das Leim Erzeugende“)“.
Glycin schmeckt tatsächlich nicht sauer. Zum Hervorrufen der Geschmacksnote sind ausreichende Mengen an freien Protonen (bzw. Hydrogenium-Ionen) notwendig. Das ist hier nicht der Fall, weil sich Glycin intramolekular selbst neutralisiert. Die Aminosäure liegt deshalb im Kristall und in wässriger Lösung stets als Zwitter-Ion vor.
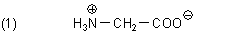
Dass Glycin überhaupt süß schmeckt, gehört zu den physiologischen Geheimnissen des Geschmackssinns. Denn Glycin hat keinerlei chemische Ähnlichkeit mit anderen süßen Substanzen wie Glycerin oder gar Zucker. Übrigens schmecken auch Bleiacetat („Bleizucker“) oder Mangan(II)-sulfat süß...
Nun bleibt noch zu klären, warum Ihr Glycin sauer schmeckte. Ich wette, Sie haben Glycin-Hydrochlorid erwischt. Viele Aminosäuren werden nämlich in dieser Form gehandelt, weil sie dann stabiler sind. Hier ist im Glycinmolekül ein zusätzliches Proton vorhanden, das in wässriger Lösung abdissoziieren kann. Folge: Dieses Glycin schmeckt richtig sauer.
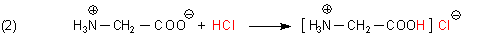
F2: Sie haben Recht…
1834
F: Warum heißt Blausäure auf Französisch „acide prussique“, also Preußische Säure?
A: Es geht um Cyanwasserstoff HCN, ein Gas, das mit Wasser eine (wenn auch äußerst schwach)
saure Lösung bildet (Cyanwasserstoffsäure oder Blausäure). Hierin ähnelt HCN in gewisser Weise dem Chlorwasserstoff HCl, der erst mit
der Brönsted-Base Wasser eine Säure bildet.
Nicht nur im Französischen, sondern auch im Englischen heißt die Blausäure entsprechend: prussic acid.
Man erhielt sie zum ersten Mal, als man den Farbstoff „Berliner Blau“ mit Schwefelsäure zersetzte.
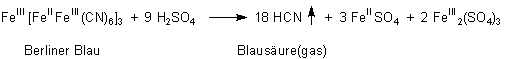
Den blauen Farbstoff erhielt man übrigens, als man Zersetzungsprodukte von Blut („Blutlaugensalze“) mit Eisensalzen vermischte.
Unsere Bezeichnung „Blausäure“ erinnert letztlich an diesen Ursprung. Auch wenn manche Leute meinen, der Name käme daher, dass man blau anläuft, wenn man mit Blausäure oder ihren Salzen (z. B. „Cyankali“) vergiftet wurde... Das klingt zum Beispiel im Filmklassiker „Das Wirtshaus im Spessart“ mit Liselotte Pulver an.
Woher nun kommt das „Preußisch“ im französischen oder englischen Sprachgebrauch? Berliner Blau war der Farbstoff der preußischen Uniformen, die in den Napoleonischen Befreiungskriegen und vor allem im Krieg 1870/71 eine für die Franzosen wohl traumatisierende Rolle spielten. Dass sich der Farbstoff gegenüber alkalischen Seifenlaugen als nicht waschecht erwies, spielte bei den damaligen hygienischen Verhältnissen sowieso keine Rolle.
Die beste (weil unpolitische) Bezeichnung ist Cyanwasserstoff(säure). Wobei Cyan aber wiederum nichts anderes als Blau(grün) bedeutet (vom Griechischen kyanos, blau)…
1835
F1: Im Unterricht der Klasse 9 kam die Frage nach den EN-Werten von Fe, Zn und Al auf.
Nach der einfachen Regel "Zunahme des EN-Werts innerhalb einer Periode und Abnahme innerhalb einer Hauptgruppe", sollten sich
die EN-Werte von Fe über Zn zu Al steigern. Das Umgekehrte ist der Fall.
Auch die Atom- und Ionenradien bieten keine Erklärungsgrundlage.
Haben Sie eine Lösung, wie ich den Schülern die 'Ausnahmen' auf einfachem Niveau nahebringen kann?
Vielen herzlichen Dank und ein großes Los für Ihre tollen Webseiten - ich schaue immer gerne nach Ideen für die Unterrichtsvorbereitung.
A1: Grundsätzlich messen Sie der Elektronegativität (abgek. EN) viel zu viel Bedeutung bei.
Vor allem ist das mit der Definition anhand der EN-Differenzen, was eine ionische oder eine "normale" chemische Bindung ist, in der Realität so eine Sache...
Aussagekräftige EN-Differenzen lassen sich tatsächlich nur anhand der Hauptgruppen des PSE relativ verständlich festmachen - und dann auch nur an den ersten drei-vier Reihen. Bei den „Nebengruppen“ (also bei den d- und f-Elementen) gilt das, was wir den Schülern zu den EN-Werten erzählen, nicht mehr. Das liegt daran, dass die Auffüllung der inneren d- und f-Schalen zu völlig verändertem Verhalten hinsichtlich der äußeren Valenzschale führt, was man nicht mit dem Verhalten der Valenzschalen der Hauptgruppenelemente vergleichen kann. In Ihrem Beispiel vermengen Sie mit der Reihe Fe-Zn-Al sogar Haupt- und Nebengruppen.
Hinzu kommt (was bei der EN-Diskussion oft verschwiegen wird), dass es darauf ankommt, welches Element Bindungspartner des betrachteten Elements ist. Beispiel: Die EN versagt beim Kohlenstoff vollständig, wenn es um die Organische Chemie geht. Vergleichen Sie Ethan, Ethen und Ethin. Dass Ethin formal eine Säure ist und Salze (Carbide) bildet, kann man nicht über den klassischen EN-Wert von Kohlenstoff herleiten, sondern man muss für jede Hybridisierung (sp3, sp2, sp) einen eigenen EN-Wert für Kohlenstoff definieren.
Stellen wir fest: Es handelt sich bei der EN um ein aus heutiger Sicht ausgesprochen schlichtes Denkmodell mit den üblichen Grenzen, die ein Modell per se immer aufweist.
Mein Tipp: Machen Sie den Modellbegriff den Schülern klar und lösen Sie eine Diskussion zum Thema „Modell in der Wissenschaft“ aus.
F2: Besten Dank für die schnelle und ausführliche Antwort, die mich genau vor das 'Problem'
stellt, das ich 'befürchtet' habe. Aber Sie haben wohl Recht, dass hier wieder einmal eine Diskussion des Modellbegriffs Not tut - auch
wenn meist nur ein kleiner Teil der Schüler diesen Weg gehen mag ...
Danke auch für Ihren ersten Satz ... Ich werde noch eine Weile darüber nachdenken und den Unterricht in Zukunft anders gestalten.