 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1836
F: Im bekanten Backe-backe-Kuchen-Gedicht gibt es eine Zeile, die ich nicht verstehe:
Safran macht den Kuchen gel.
Bei Gel denke ich an einen ungeordneten Zustand der Materie, wie wir es zum Beispiel von Gelatine her kennen.
Ein „geler“ Kuchen war für uns ein selbstgebackener Kuchen, der nicht ganz durchgebacken war und innen noch glasig („klitschig“)
aussah. Er schmeckte entsprechend mies…
A: Das Liedchen geht so:
Backe, backe Kuchen,
|
Ich habe das Lied früher auch nie so richtig verstanden. Mittlerweile meine ich, dass es sich offenbar bei diesem „Gel“ um eine Kurzform für „Gelb“ handelt. Denn Safran ist der gelbe Farbstoff von Krokus-Blütenstaub.

(Foto: Blume)
Safran enthält einen gelben Farbstoff mit dem Namen Crocin. Er ist das wasserlösliche Glykosid des Crocetins. (Die Zucker binden an die beiden Carboxylgruppen.) Crocetin ist übrigens ein typisches Carotinoid:

Die Zeile muss richtig also heißen:
Safran macht den Kuchen gelb.
Aber dann reimt es sich nicht mehr so schön…
1837
F: Warum schmeckt Rollmops überhaupt nicht nach Fisch?

(Foto: Blume)
A: Sie meinen sicherlich nicht den Geschmack, sondern den Geruch.
Denn wir haben keinen Geschmack für „fischig“.
Der Fischgeruch resultiert von Aminen, die „fischig“ riechen. Amine entstehen, wenn der Fisch aufgrund längerer Lagerung anfängt zu verderben.
Amine sind organische Homologe von Ammoniak und sind wie letzterer oftmals flüchtige Basen, die als Gas/Dampf in unsere Nasen gelangen.
Die den Fischgeruch auslösenden Stoffe sind im Rollmops-Sud letztlich durchaus noch latent vorhanden, liegen aber in geruchloser Form vor: Im Aufguss-Sud des Rollmopses sind reichlich Säuren (Citronensäure, Essigsäure, Milchsäure) enthalten, die mit den flüchtigen Aminen zu nicht mehr flüchtigen Salzen reagieren. Das liegt an den elektrischen Ladungen der beteiligten Ionen.
Man kann den im Sauren „maskierten“ Geruch wieder aktivieren, indem man den Sud mit Natronlauge neutralisiert oder besser noch alkalisch einstellt. Man kann auch Sodalösung nehmen. Klicke hier.
Übrigens hat man einige Zeit nach dem Genuss von Rollmops ebenfalls einen fischigen „Geschmack“ im Mund. Grund: Der Speichel wirkt als alkalischer Puffer.
Wir haben zum Säureeinsatz gegen Fischgeruch übrigens den Tipp des Monats Nr. 63.
1838
F1: Guten Tag mein Name ist (…)
Erst einmal wollte ich ihnen sagen, dass ich ihre Seite sehr hilfreich und informativ finde.
Ich habe aber selbst noch ein paar Fragen und hoffe sie können mir weiterhelfen.
Meine erste Frage ist, woran erkenne ich welches Ion positiv oder negativ geladen ist. Wenn es nur jeweils ein Stoff ist zum Beispiel ein Brom-Ion und ein H-Ion kann ich im Periodensystem nachschauen, also wäre das Brom-Ion negativ und das H-Ion positiv geladen, was aber, wenn ich 2 Molekül-Ionen habe? Woran kann ich die Ladung erkennen?
Und meine zweite Frage ist, woran erkenne ich, welcher Stoff die Base und wer die Säure ist, also bevor man das Produkt erhält,
nur wenn man die Formel stehen hat.
Wenn im Namen Säure enthalten ist, zum Beispiel Schwefelsäure ist es ja meist die Säure, also der Donator, aber was wenn nicht?
Es wäre total toll, wenn sie mir helfen könnten. Danke schon mal im Voraus.
A1: Deine Fragen zu beantworten, ist sehr schwer. Aber ich gehe mal davon aus, dass du im
Anfangsunterricht der Chemie stehst.
Zur ersten Frage: Du musst wissen, in welcher Form das Atom vorliegt. Nehmen wir das Sulfat-Ion. Da hat der Schwefel formal eine (6+)-Ladung, der Sauerstoff (wie im Wasser) eine (2-)-Ladung. Man spricht von einer Oxidationszahl. (Die musst du kennen. Man kann sie aber auch aus dem Periodensystem herauslesen.) Zähle nun zusammen: (6+) + 4 X (2-) = (2-). Das ist die Ladung des Sulfat-Ions; seine Formel ist SO42-. Die Formel der zugehörigen Schwefelsäure ist H2SO4.
Leider musst du im Anfangsunterricht der Chemie vieles auswendig lernen.
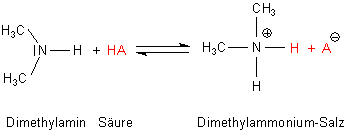
Das gilt auch für die zweite Frage: Das mit den Wasserstoffatomen als Signal für das Vorliegen einer Säure gilt nicht immer. So sind die bedeutendsten Stickstoffbasen Wasserstoffverbindungen – wie das Ammoniak NH3. Das ist als Base sogar ein Protonen-Akzeptor:
NH3 + H+ ———> NH4+
F2: Danke schön, das hat mir weitergeholfen.
liebe grüße
(…)
1839
F: Erstmal Gratulation zu der tollen Seite!
Da sie anscheinend der Einzige sind, der was über Schleimsäure weiß, folgende Frage:
Bei ihrem Versuch wird ja Salpetersäure als Oxidator verwendet, ginge das auch mit anderen
Oxidationsmitteln wie Wasserstoffperoxid oder Kaliumpermanganat?
Ich würde nämlich diesen Versuch gerne erfolgreich durchführen, nur ist es leider nicht gerade einfach an konz. Salpetersäure zu kommen...
Ich hab es mal versucht, Lactose (3.5 g) in 30% H2O2 (5 ml) zu erhitzen...
Nach Eindampfen ergab es eine hochviskose Flüssigkeit, die beim Abkühlen hart wurde.
Geschmackstest: Sauer
Wasser mit Natriumcarbonat dazu => Auflösung unter Blasenbildung.
Könnte das Schleimsäure sein oder eher was total anderes?
A: Konzentrierte Salpetersäure bekommen Sie als Normalbürger nicht mehr. Die kann man ja
im Sinne eines Dual Use auch als Stoff zur Herstellung von Sprengstoffen nutzen.
Man kann nicht jedes beliebige Oxidationsmittel nehmen. 30%iges H2O2 ist zu aggressiv. Es bilden sich damit
zwar auch Säuren - aber durch unspezifische Spaltung der Zuckermoleküle. Außerdem müssen Sie saures Milieu haben, damit vor der
eigentlichen Oxidation die Lactosemoleküle zur Freisetzung der Galactose gespalten werden. Schleimsäure ist bekanntlich ausschließlich
D-Galactonsäure.
Natürlich können Sie oxidieren, womit Sie wollen. Ihr Problem ist nur, dass Sie die Produktmischung analysieren und ggf. auftrennen müssen. Das geht nicht ohne apparativen Aufwand.
Aber auf keinen Fall Geschmackstests machen!
1840
F: Gerne übernehme ich für meinen Chemieunterricht an einer Realsschule Experimente in meinen
Unterricht von Ihrern tollen Internet Seite .
Z.Z. führe ich dir Versuch mit Kaisernatron durch und habe in der letzten Unterrichtstunde gemäß Ihrer Anordnung Kaisernatron mit
dem Brenner erhitzt.
Seltsamerweise sind 2 von 3 RG geschmolzen, was normalerweise nicht passiert. Die Schüler haben den Brenner auch nicht so hoch
erhitzt, daß dies eigentlich nicht zu erwarten war.
Vielleicht probieren Sie es einfach noch mal aus, auch mir ist dies beim "Vorexperiment" nicht passiert.
Liegt dies daran, dass das entstandene Natriumcarbonat einen Einfluss auf die Schmelztemperatur des Rg hat oder war dies einfach ein seltsamer Zwischenfall?
A: Uns ist das noch nicht passiert, auch nicht unseren Studenten.
Ich kann natürlich keine Ferndiagnose erstellen. Aber ich gehe davon aus, dass die Schüler mit zu heißer Flamme und mit der Spitze
des Flammenkegels immer nur einen Punkt des Reagenzglases erhitzt haben. Schließlich beträgt die Temperatur der Kegelspitze über 1800 °C
(manche sagen: sogar über 2000 °C), auf jeden Fall genug, um bei anhaltender Einwirkung auch hochwertiges Glas zum Schmelzen zu bringen.
Wenn Sie den Versuch machen lassen, achten Sie darauf, dass die Schüler mit moderater Flammenhitze (zwischen „leuchtend“ und „rauschend“)
arbeiten und dazu fächelnd die ganze Füll-Fläche des Reagenzglases erhitzen.