 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
2011
F: (S4)2+ hat ja 6 delokalisierte Elektronen, weswegen es zu
den Pseudoaromaten gehört. Wie sieht diese Verbindung aber in Lewis-Schreibweise aus? Ich hab schon mehrere Versuche gestartet,
aber irgendwie klappt das nicht so recht. Und wieso gehört es nicht zu den Aromaten?
A: Das S4(2+)-Kation erfüllt formal die
Hückel-4n+2-Regel und ist damit als aromatisch zu bezeichnen.
Die Begriffe pseudo- oder quasiaromatisch sind nicht nur mir nicht geläufig und werden in der Literatur auch kaum verwendet (Ausnahme z. B.: Holleman-Wiberg). Ich meine, dass hier jemand einen Begriff eingeführt hat, um "klassische" (also organische) Aromaten wie z. B. das Benzol von den anorganischen zu unterscheiden.
Hier sind zwei wichtige Grenzstrukturen-Typen der mesomeren Zustände des Schwefel-Kations. Es gibt noch eine weniger wahrscheinliche co-ionische Struktur, bei der ein S-Atom zwei positive Ladungen trägt.
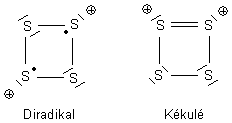
PS: Ich habe eben die Leute ausgemacht, die den Begriff pseudo-aromatisch „erfunden“ haben:
Ralf Alsfasser, H. J. Meyer: Moderne Anorganische Chemie, de Gruyter, 2007
Auf Seite 125 beschreiben sie genau das, was ich vermute: Die beiden haben den Begriff zur Unterscheidung von organischen und anorganischen Aromaten eingeführt.
2012
F: Warum heißt der rote Farbstoff „Zinnober“, wo es doch kein Zinn enthält.
Vielleicht schwimmt das Sulfid bei der Bildung oben? Ich denke an das österreichische „Schlagobers“ für Schlagsahne, die auf dem Kaffee schwimmt.
A: Richtig. Zinnober ist die rote Modifikation des Quecksilbersulfids, HgS. Es enthält kein Zinn.
Es hat auch nichts mit dem Schlagobers zu tun.
Der Name kommt aus dem Griechischen, abgeleitet vom Wort kinnábari für Zinnober. Auch die Römer kannten das Mineral bereits, z. B. aus den Quecksilberminen ihrer iberischen Provinz (heute Spanien), und nannten es cinnabaris. Das Wort soll übrigens letztlich persischen Ursprungs sein.
Cinnabaris hat sprachlich nichts mit unserem Zinn zu tun; dieses Metall hieß bei den Römern stannum. Daher stammt das chemische Symbol Sn.

Cinnabarit mit Quecksilbertröpfchen
(Foto: Blume)
Das Mineral heißt wissenschaftlich Cinnabarit. Es ist auch heute noch das wichtigste Quecksilbererz. Wer es in seiner Sammlung hat, sollte wissen, dass es zu den giftigen Erzen gehört.
2013
F: Ich habe gelesen, dass nun ein neuer atmosphärischer Problemstoff aus industrieller
Produktion aufgetreten ist, Stickstofftrifluorid. Der soll „ein besonderer Klimakiller sein, da er 17.220 Mal so schädlich ist
wie CO2“. Was ist das für eine Substanz, und wofür benötigt man sie?
A: Stickstoff-trifluorid ist ein Gas. Es hat die chemische Formel NF3.
Sein Molekül ist ähnlich pyramidal aufgebaut wie das von Ammoniak. Es zeigt eine besonders starke Absorptionsfähigkeit für
Infrarot-Strahlung, die stärker ist als die von CO2. NF3 fördert deswegen stark den Treibhauseffekt.
Diese Substanz ist ein starkes Oxidationsmittel und vermag ansonsten auch Fluoratome zu übertragen. Dieses Potential nutzt man bei der Produktion von Elektronikbauteilen sowie von Flachbildschirmen. Dort müssen in einem Produktionsschritt Reste von Siliciumverbindungen wie SiO2 oder Si3N4 (Siliciumnitrid) entfernt werden. Dabei entstehen aus den festen Siliciumverbindungen gasförmige Produkte, die abgesaugt werden können. Hier ist eine schematische Reaktionsgleichung:
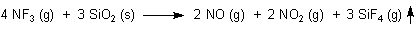
2014
F: Für meinen Leistungskurs Chemie habe ich Ihren Versuch
ausprobiert. Zwar lief die Herstellung wie geplant. Leider zeigte Fluorescein aber schon ohne Zugabe von Natronlauge eine sehr deutliche
Fluorescenz, die sich nach Zugabe von Natronlauge nicht drastisch verstärkte. Das Löschen der Fluorescenz mit Salzsäure gelang leider
nicht - wie in der Durchführung beschrieben.
Können Sie mir für dafür eine Erklärung geben? Ganz herzlichen Dank im Voraus!
A: Es ist für mich schwer, Ferndiagnosen zu geben. Ich will es versuchen.
Zu Betrachten der Fluoreszenz sollte man immer zwei Gläser nutzen: Eine deutlich sauer, die andere nach Laugenzugabe. Die halten Sie nebeneinander ins helle Licht (am Besten direktes Sonnenlicht) und betrachten die Lösungen von oben.
Dass bei Ihnen die Fluoreszenz immer zu erkennen ist, liegt sicher daran, dass die Lösungen, mit denen Sie den Effekt bei Laugenzugabe zeigen wollen, viel zu konzentriert sind. Denn die Menge an Farbstoff, die wir in unserem Reagenzglasversuch herstellen, reicht, um mehrere große Schwimmbecken einzufärben und den Effekt der Fluoreszenz zu zeigen.
Im Säure/Base-Gleichgewicht des Farbstoffs ist auch im sauren Milieu immer eine ausreichende Menge an fluoreszenzfähigen deprotonierten Molekülen vorhanden. Je höher die Konzentration des Farbstoffs ist, desto mehr fällt einem Betrachter die Fluoreszenz auf.
2015
F: Ich möchte in meinem 2. Staatsexamen mit meinen Schülern der Sache auf den Grund gehen,
warum sich blaue Tinte killen lässt, rote jedoch nicht und schwarze (ich konnte auf dem Flohmarkt glücklicherweise noch eine alte
Lamy Tinte ergattern) nicht.
Bei der Chromatographie der schwarzen Tinte mittels eines Rundfilters (Laufmittel: Wasser) hat sich die schwarze Tinte in drei
Farben aufgeteilt: blau, orange und grün. Nach dem Trocknen und anschließendem Killern konnte die blaue Tinte unsichtbar gemacht
werden, die Grüne Farbe blieb und die orange Farbe wurde nach und nach gelb. Dies ist mein Problem: Warum wird aus orange gelb?
Ich gehe laut Chromatographie davon aus, dass die schwarze Tinte aus einem Gemisch von drei Farben besteht. Könnte es sein,
dass der orange Farbstoff so mit den Sulfit reagiert, dass ein Teil des konjugierten Doppelbindungssystems sozusagen gestört ist
und nur noch Licht im blau-violetten Bereich, also energiereicher, absorbiert werden kann?
A: Kennen Sie meinen Tipp des Monats Nr. 75 zum Tintenkiller?
Dass sich die schwarze Farbe in die drei subtraktiven Grundfarben Gelb, Türkis und Purpur auftrennt, ist bekannt. Klicken Sie z. B. hier.
Es ist problematisch, den Farbkillereffekt oder sein Ausbleiben anhand dieser Farbmischung zu erklären, weil wir nicht wissen, welche Farbstoffe darin enthalten sind. Es gibt ja schließlich nicht nur die durch Tintenkiller angreifbaren Triphenylmethan-Farbstoffe.
Warum Eosin, der rote Farbstoff der Lehrertinte nicht gekillt werden kann? Kurz gesagt: Seine Farbigkeit beruht nicht auf der Triphenylmethan-Konstellation. Wir erklären das hier.