 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
2136
F: In der Klinik wurde bei mir eine PET mit radioaktiven Substanzen gemacht. Ist die nicht schädlich
für die Gesundheit?
A: PET ist die Abkürzung für Positronenemissions-Tomografie.
Tomografie ist die allgemeine Bezeichnung für computergestützte Verfahren, bei denen durch den Körper Schnitte gelegt werden, die dann mit entsprechender mathematischer Software zur dreidimensionalen Abbildung der Dichteverteilung ausgewertet werden (griech. thome, Schnitt; grafein, abbilden).
Bei der klassischen Computer-Tomografie (CT) werden zur Abbildung Röntgenstrahlen benutzt. Bei der Magnetresonanz-Tomografie (MRT) wird die Wechselwirkung zwischen Protonen und einem starken Magnetfeld gemessen (früher auch Kernspin-Tomografie genannt). Letztere leitet sich von der allen Chemikern vertrauten NMR-Messmethode (Kernspinresonanz) ab.
Bei der PET verabreicht man dem Patienten radioaktiv markierte Substanzen. Diese enthalten Radionuclide, welche Positronen (positiv geladene Elektronen; Symbol β+) abstrahlen. Solche β+-Strahler sind Kohlenstoff-13 oder Fluor-18, die z. B. gebunden in Glucose verabreicht werden. Die Positronen reagieren mit Elektronen (negativ geladen; Symbol β-), wobei sie sich unter Aussendung von Gamma-Photonen eliminieren. (Man übersetzt die Abkürzung PET deshalb manchmal auch nicht ganz richtig mit Photonen-Emissions-Tomografie.) Diese Gamma-Photonen werden durch spezielle Kristalldetektoren, die in der Röhre rundherum angeordnet sind, registriert. Das Prinzip kennt man schon lange von den so genannten Szintillations-Zählern.
Je aktiver ein Gewebe ist, desto mehr energiespendende Glucose reichert sich an und desto mehr Gamma-Photonen werden registriert. Man macht deshalb mit der PET z. B. Herzfunktionstests oder misst die Aktivität von durch entsprechende Reize angeregten Gehirnregionen.
Die PET wird jedoch vor allem zur Krebsdiagnose verwendet. Denn Krebszellen reichern aufgrund ihres verstärkten Stoffwechsels Moleküle wie die von Glucose an - folglich gilt das auch für die radioaktiv markierten Moleküle. Damit werden Geschwulste und sogar einzelne, im Körper vagabundierende Krebszellen (Metastasen) erkennbar gemacht.
Zum gesundheitlichen Aspekt: Die PET-Methode arbeitet mit derartig geringen Konzentrationen an radioaktiven Substanzen, dass eine Gefährdung des Patienten nicht zu befürchten ist.
2137
F: In einem Kreuzworträtsel wird ein „Oxidationsprodukt“ mit vier Buchstaben gesucht. Zwei Buchstaben
stehen schon da:
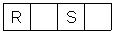
Nun haben wir uns darüber unterhalten, ob das RUSS oder ROST sein könnte. Dass Rosten die Oxidation von Eisen voraussetzt, wissen wir. Das erkennen wir daran, dass Rost ein Oxid ist. Verwirrend für uns ist: Hat aber Oxidation nicht etwas mit Verbrennung zu tun? Was brennt beim Verrosten?
Und wie ist das mit dem Ruß? Da waren wir uns nicht einig. Ruß entsteht beim Verbrennen von Holz (usw.). Demnach ist es ja wohl auch ein Oxidationsprodukt. Aber wo ist dann der Sauerstoff?
A: Sie alle haben zugleich Recht und Unrecht.
Beim Rost stimmt das mit dem Sauerstoff im Oxidationsprodukt. Rost ist Eisenoxidhydroxid FeO(OH). Beim Rosten findet jedoch keine Verbrennung statt, sondern eine „stille“ Oxidation; man spricht von Korrosion.
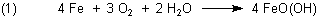
Anders ist es beim Ruß. Es handelt sich bei ihm um elementaren Kohlenstoff (genau um Graphit). Er enthält keinen Sauerstoff. Ruß entsteht unter anderem bei der unvollständigen Verbrennung von Kohle. Kohle ist ein kompliziert aufgebauter Kohlenwasserstoff. Ähnliches gilt für Holz oder Papier und andere Biomasse. Nehmen wir als Modellsubstanz Benzol C6H6, bei dessen Verbrennung besonders viel Ruß entsteht.
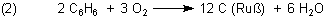
Die Reaktion läuft letztlich so ab, dass der Sauerstoff den Kohlenstoffatomen die Wasserstoffatome entreißt. Man spricht von unvollständiger Verbrennung, weil die Verbrennung noch weitergehen kann. Denn wenn man mehr Sauerstoff zur Verfügung hat, kann die Verbrennung vollständig erfolgen; dann werden auch die Kohlenstoffatome angegriffen. Die Reaktionsprodukte enthalten nun deutlich gebundenen Sauerstoff, weil sich CO2 gebildet hat.
Wer chemisch etwas versierter ist, kann auch mit Oxidationszahlen argumentieren. Eine Zunahme der Oxidationszahl bedeutet Oxidation - auch wenn in dem Reaktionsprodukt kein Sauerstoff gebunden ist. Im Benzol ist die Oxidationszahl des Kohlenstoffs (-I), im Ruß beträgt sie (0). Beim CO2 ist sie (+IV).
2138
F: Wieso haben Nüsse, die doch als so gesund gelten, derartig viel Kalorien?
A: Der Kaloriengehalt ist tatsächlich sehr hoch. Das gilt auch für Pflanzenkerne wie von Mandelbaum, Kürbis oder Sonnenblume. Hier ein paar Beispiele:
| Nuss - bzw. Kern-Art | Kcal (100 g) |
kJoule = Kcal · 4,187 |
|---|---|---|
| Erdnüsse | 567 | 2376 |
| Walnüsse | 654 | 2740 |
| Haselnüsse | 628 | 2631 |
| Paranüsse | 670 | 2807 |
| Kokosnüsse | 660 | 2765 |
| Macadamia-Nüsse | 718 | 3008 |
| Mandelkerne | 575 | 2409 |
| Kürbiskerne | 446 | 1867 |
| Sonnenblumenkerne | 584 | 2447 |
Das Problem der hohen Kalorienzahl liegt am hohen Fettgehalt. Der ist bei den Nüssen so groß, dass man damit auf Papier leicht Fettflecke produzieren kann.
Nüsse sind quasi Pflanzen-Embryos, die von ihren Eltern mit allem ausgestattet worden sind, was sie zum Austreiben benötigen: Proteine, Kohlenhydrate, Vitamine, Mineralstoffe und vor allem viele Fette (besser: Lipide). Dieses sind alles Stoffe, die auch uns gut tun, deshalb gelten die Nüsse als gesunde Nahrung.
Fette liefern die Energie für das Anfangswachstum der Pflanzen. Denn die Fette sind wahre „Kalorienbomben“ – leider auch für uns Menschen…
Wenn der Pflanzen-Keim schließlich das erste Mal Licht „erblickt“, setzt die Photosynthese ein. Von nun an produziert die Pflanze ihre eigenen Stoffe. Sie ist quasi autark geworden.
2139
F: Wie kann man begründen, dass die Aminosäure Leucin trotz der unpolaren Seitenkette besser in Wasser löslich ist und die höhere Schmelztemperatur aufweist, als Glutaminsäure? Klassischerweise ist die Glutaminsäure durch die zweite Carboxylgruppe doch viel polarer. Höhere Siedetemperaturen und gute Löslichkeit (zumindest besser als Leucin) sollten doch die Folge sein…
A: So einfach, wie Sie meinen, ist das Ganze nicht. Hier sind zunächst die Werte, von denen Sie sprechen:
| Aminosäure | Abkürzung | Schmelzpunkt °C | Löslichkeit (g/L; 20 °C) |
|---|---|---|---|
| L-Leucin | Leu | 293-295 | 24 |
| L-Glutaminsäure | Glu | 166 | 11,1 |
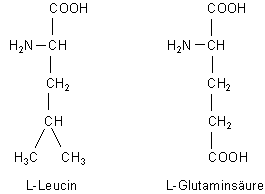
Zur Abschätzung von Schmelzpunkt und Löslichkeit benötigt man die Werte einiger Energien: Die Gitterenergie der Kristalle gibt Aufschluss über die Schmelztemperatur. Über die Löslichkeit entscheidet neben der Gitterenergie auch noch die Hydratationsenthalpie mit. Die realen Werte sorgen manchmal für große Überraschungen.
Man kann natürlich spekulieren, weshalb die polare COOH-Gruppe von Glu nicht die Löslichkeit steigert. Oder warum der unpolare Isobutylrest von Leu die Löslichkeit nicht behindert. Und welche Rolle die Zwitter-Ionenstruktur spielt. Aber es gilt grundsätzlich: Man kann nicht ohne weiteres von den Strukturen bzw. von der Ladungsverteilung innerhalb der Moleküle auf den Aufbau ihres Kristallgitters schließen.
Als Beispiel sei an die Glucose erinnert: Obwohl die Bildung von α-Glucose gegenüber der von β-Glucose energetisch bevorzugt ist, liegt nach der Gleichgewichtseinstellung (Mutarotation) in wässrigen Lösungen überwiegend β-Glucose vor. Die Ursachen für dieses anscheinend merkwürdige Verhalten beschreiben wir hier.
2140
F: Warum haben Birken eine weiße Rinde?
A: Ich bin zwar kein Biologe, kann aber trotzdem eine Antwort geben, da sich dahinter eine Menge allgemeiner Naturwissenschaft versteckt.
Birken wachsen in nördlichen Breiten und bilden dort lockere Wälder. In diesen Tundren ist es sehr kalt – man spricht auch von Boreal-Zone (griech. boreas, kalter Nordwind).

Birkenwäldchen in der Senneheide und Birkenrinde (Foto: Blume)
Wenn im Frühjahr die Sonne zu scheinen beginnt, „schießt der Saft in die Bäume“ – wie man treffend sagt. Wird es nachts wieder knackig kalt, kann der Saft in der Rinde gefrieren und das Gewebe zerstören. Das gilt besonders für freistehende Bäume mit dunkler Rinde.
Weiße Rinde dagegen absorbiert weniger Strahlungsenergie. Deshalb heizt sich die Birke mit der ersten Frühjahrssonne nicht so stark auf und schießt auch nicht sofort in den Saft. Unterstützt wird das noch durch die Glätte und den Glanz der Rinde, was die Reflexion der Strahlung stärkt und damit die Einstrahlung noch mehr abschwächt.
Die Entwicklung der weißen Rinde hat der Birke somit gegenüber Bäumen mit dunkler Rinde einen evolutionären Vorteil verschafft.
Achten Sie übrigens einmal auf Folgendes: In unseren Breiten wird die dunkle Rinde von Obstbäumen auf gepflegten Streuobstwiesen aus den gleichen Gründen mit Kalkbrühe weiß angestrichen. Täte man das nicht, könnte die Rinde bei Spätfrost aufreißen.
Birkenrinde ist übrigens auch ein interessanter Rohstoff. Aus ihr hat man schon seit langer Zeit durch Destillation Pech gewonnen. Das war früher ein Allerweltsklebstoff, sozusagen das UHU® oder Pattex® der Steinzeit. Mit dem wurden zum Beispiel Steinbeile, Messerklingen oder Sichelsteine aus Feuerstein in ihren Fassungen befestigt.