Prof. Blumes Tipp des Monats März 2009 (Tipp-Nr. 141)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.

Für Fortgeschrittene:
a-Glucose oder b-Glucose?
Immer wieder werde ich gefragt, wovon es abhängt, ob sich a-D-Glucose oder b-D-Glucose bildet. Das ist deshalb sicherlich etwas für den Tipp des Monats! Da kann man wieder viel Chemie lernen – aber das ist diesmal zugegebenermaßen nichts für Anfänger…
|
Sehr geehrter Prof. Blume!
Ich hoffe, dass sie mir bei diesen Fragen weiterhelfen können. Vielen Dank für ihre Hilfe! |
Hier kommt…
… die Vorgeschichte
Bei einfachen Zuckern (also bei den Monosacchariden) findet zwischen einer Hydroxylgruppe und der
Carbonylgruppe durch Addition eine intramolekulare Ringbildung statt. Die Verbindungen heißen
Halbacetale.
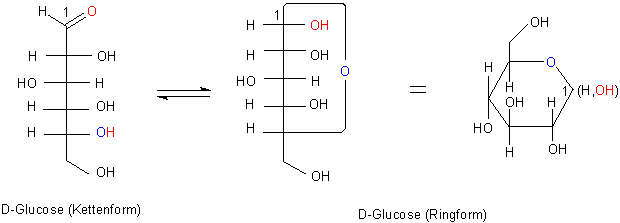
Bild 1: Ringschluss bei der D-Glucose
Beim Betrachten des Produkts, das durch den Ringschluss aus der linearen Carboxylverbindung entsteht,
fällt auf, dass aufgrund der räumlichen Anordnung der neu gebildeten Hydroxylgruppe am C-Atom 1 zwei Isomere
möglich sind.
Diese Isomere nennt man Anomere. Man bezeichnet sie mit den griechischen Buchstaben a und b: a-D-Glucose oder b-D-Glucose.
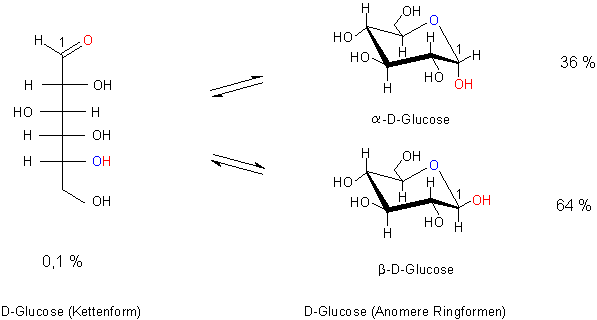
Bild 2: Bildungsgleichgewicht der Anomeren der D-Glucose
In wässriger Lösung bildet sich ein Gemisch der beiden Anomere. Eigentlich ist zu erwarten, dass sich beide
Anomere in gleichen Mengen bilden. Schließlich ist das ja auch bei der spontanen Bildung von optischen Isomeren
wie den Enantiomeren der Fall: Das Racemat, das sich dabei bildet, besteht zu je 50 % aus
linksdrehenden und rechtsdrehenden Molekülen.
Wenn man das bei den Anomeren untersuchen will, benötigt man die entsprechenden Kenndaten der reinen Substanzen, also der a-D-Glucose und b-D-Glucose. Die muss man erst einmal herstellen!
Wie man die reinen Glucose-Anomere herstellt und was sie unterscheidet
Lässt man Glucose aus weniger polaren Lösemitteln wie gekühltem Ethanol auskristallisieren, erhält man
ausschließlich die a-D-Glucose.
b-D-Glucose erhält man in reiner Form, indem man sie aus Pyridin auskristallisieren lässt.
Wir merken schon: Es muss wohl größere Unterschiede zwischen a-D-Glucose
und b-D-Glucose geben, wenn ihre Kristallisation nur eine Frage des Lösemittels ist.
Denken wir weiter daran, dass sich aus der a-D-Glucose Stärke und aus der
b-D-Glucose Cellulose bildet.
Ihre Disaccharide (Maltose und Cellobiose) schmecken unterschiedlich süß.
Sie werden auch von verschiedenen Enzymen umgesetzt.
Sie sind zwar beide optisch aktiv; jedoch sind die Winkel der durch sie verursachten optischen Drehung der Ebene
des polarisierten Lichts dem Wert nach völlig unterschiedlich.
Es handelt sich bei den Anomeren a-D-Glucose und b-D-Glucose somit nicht um spiegelbildliche Enantiomere, wie es die D-Glucose oder L-Glucose sind. Denn letztere sind chemisch identisch (abgesehen von den stereospezifischen Reaktionen mit Enzymen). Ihre Drehwinkel der Ebene des polarisierten Lichts unterscheiden sich nur dem Vorzeichen nach.
Die Glucose-Anomere sind somit ein Beispiel für den Spezialfall der Stereochemie und der optischen Isomerie: Sie sind Diastereomere.
Die Reaktionsgruppe in Bild 2 ist ein chemisches Gleichgewichtssystem
Wenn man reine a- oder reine b-D-Glucose in Wasser löst, stellt
sich ein Gleichgewicht zwischen den beiden Anomeren spontan ein, auch wenn das ziemlich langsam geht. (Das hat den
Vorteil, dass man die spezifische Drehung der reinen Anomeren gut bestimmen kann.) In das Gleichgewichtssystem ist auch
die offene Kettenform der Glucose eingebunden.
Die ansonsten tagelang andauernde Reaktion kann man durch Zugabe von Spuren einer schwachen Base wie Soda, Ammoniak oder natürlich auch Pyridin so stark beschleunigen, dass sich das Gleichgewicht fast augenblicklich einstellt.
Die Reaktion zur Einstellung des Gleichgewichts bezeichnet man als Mutarotation (lat. mutare, verändern; rotare, drehen). Sie lässt sich mit Hilfe der Veränderung der optischen Aktivität der Lösung verfolgen. Das macht man durch Messung des Drehwinkels mit einem Polarimeter.

Bild 3: Modernes Polarimeter. Vorn liegt die thermostasierbare Küvette
(Foto: Daggi)
|
Versuch 1: Mutarotation
2 In einem zweiten Ansatz geben wir zu der Lösung einen Tropfen verdünnte Ammoniaklösung
(Xi) und messen erneut.
Hinweis zur Auswertung
Hinzu kommt noch der Einfluss der Temperatur. Die spezifische Drehung ist für 20 °C definiert. Daher kann es im Schullabor zu Abweichungen im Messergebnis kommen. Zu vergessen ist auch nicht, dass Glucose oftmals als Hydrat verkauft wird. Dann stimmt die Einwaage nicht. |
Bild 4 zeigt die Änderung der optischen Drehung ohne Zugabe von ringöffnenden Basen über
eineinhalb Tage hinweg.
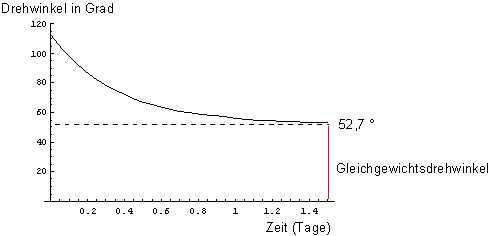
Bild 4: Messung der Änderung des Drehwinkels in wässriger Lösung; ausgehend von der a-D-Glucose (ohne basischen Katalysator)
(Zur Berechnung dieser Kurve und der Kurven der folgenden Bilder 5 und 6 klicke hier.)
Die Ursache für die Reaktionsbeschleunigung durch Basen ist, dass sie Halbacetale spalten, bei Zuckern also den Ring öffnen. Aus der auf diese Weise entstandenen Kettenform erfolgt ständig erneuter Ringschluss, begleitet von einem Richtungswechsel der Hydroxylgruppe am C-Atom 1 – wie Bild 2 zeigt. (Zur Chemie der Halbacetale klicke hier.)
Wie berechnet man die Konzentrationen der beiden Anomeren?
Nach Erreichen des Gleichgewichtszustands misst man die spezifische optische Drehung [a]Mess
= +52,7°. Das ist übrigens auch der Wert, den man für eine wässrige D-Glucoselösung tabelliert findet.
Der spezifische Drehwinkel von reiner a-D-Glucose beträgt [a]a = +112,2°, die spezifische Drehung der b-D-Glucose ist dagegen nur [a]ß = +18,7°.
Der Gleichgewichtswert in der wässrigen Lösung ist also keineswegs das arithmetische Mittel der Drehwinkel von jeweils reiner a-D-Glucose und b-D-Glucose.
Zur Berechnung der Konzentrationen der beiden Anomeren muss man wissen, dass die Drehung des polarisierten Lichts proportional zu den Konzentrationen der optisch aktiven Substanzen ist. Das ist so ähnlich wie beim Lambert-Beerschen Gesetz, das für die photometrische Analyse gültig ist. Was dort der Extinktionskoeffizient el ist, ist hier die spezifische Drehung [a]. Es handelt sich in beiden Fällen um charakteristische Kenngrößen von chemischen Stoffen. Bei Mischungen von optisch aktiven Substanzen kann man die Werte der einzelnen Anomeren addieren und erhält so den Gesamtdrehwinkel der Mischung.
Zunächst aber zu den Konzentrationen der Anomeren. Hier folgt die Rechnung. Keine Angst: Das ist Mathematikstoff der Mittelstufe… Das wäre doch mal eine Anregung für den praxisorientierten Mathematikunterricht.
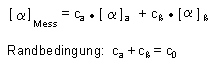
Die Symbole ca und cß beschreiben die aktuellen Konzentrationen der beiden Anomere. Die Start-
oder Gesamtkonzentration ist co.
Kombinieren wir die beiden Gleichungen, so folgt:
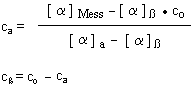
Wir setzen co = 1 und setzen die oben genannten spezifischen Drehwinkel der beiden Anomeren ein. Dann erhalten wir die uns schon bekannten relativen Konzentrationen der beiden Anomere.
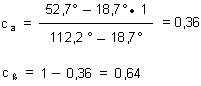
Nun berechnen wir umgekehrt auch noch den Gleichgewichtsdrehwinkel.
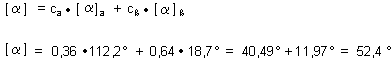
Die Abweichung vom in der Literatur zitierten Messwert +52,7 ° sollte man (wie wir bei der Auswertung zu Versuch 1 gesagt haben) nicht besonders überbewerten…
Das folgende Bild 5 zeigt, wie sich die Drehwinkel der beiden Anomere im Verlauf der Mutarotation ändern.
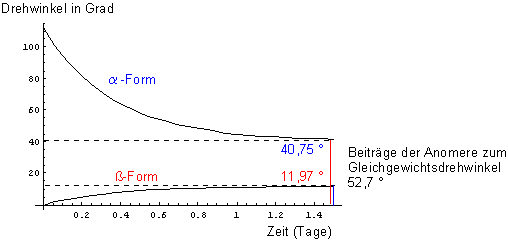
Bild 5: Kinetische Kurven zur Gleichgewichtseinstellung zwischen den Anomeren von D-Glucose in wässriger Lösung. Gestartet wurde mit der a-D-Glucose. Gezeigt wird, in welchem Umfang die beiden Anomere zur Änderung des gesamten Drehwinkels in Bild 4 beitragen
Durch Addition der Ordinatenwerte dieser beiden Kurven erhält man die Messwert-Kurve in Bild 4.
Die Gleichgewichtskonstante
Wir haben berechnet, dass im Fall der D-Glucose in wässriger Lösung das b-Anomere mit 64 %
gegenüber der a-Form bevorzugt wird, die nur mit 36 % vorliegt.
Den kleinen Anteil an offenkettigen Formen kann man vernachlässigen. Das kann man mit dem bekannten Aldehydnachweis nach Schiff zeigen.
|
Versuch 2: Nachweis von offenkettig vorliegender Glucose
|
Es stellt sich die Frage, warum die saure Lösung von Schiffs Reagenz nicht auch die Öffnung der Halbacetalrings fördert,
da es wie auch die basischen Katalysatoren zumindest den Ringschluss katalysiert. Dann
müsste sich die Lösung zunehmend rot färben, weil sich das Hydrogensulfit-Addukt des offenkettigen Zucker-Aldehyds bildet.
Zur Beantwortung dieser Frage klicken Sie hier und wählen Sie Frage 1821.
In Bild 6 zeigen wir, wie sich die Konzentrationen der beiden Formen ihren Gleichgewichtswerten
annähern.
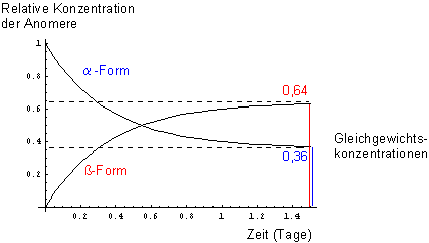
Bild 6: Kinetische Kurven zur Gleichgewichtseinstellung zwischen den Anomeren von D-Glucose in wässriger Lösung. Gestartet wurde mit der a-D-Glucose
Aus den Gleichgewichtskonzentrationen lässt sich die Gleichgewichtskonstante berechnen.
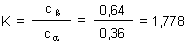
Jetzt bleibt noch die eigentliche Frage dieses Tipps: Warum eigentlich ist die b-D-Glucose gegenüber der a-D-Glucose bevorzugt? Kann man das erklären?
Wovon die Bevorzugung einzelner Anomere abhängt
Wie schon gesagt: Es bilden sich keineswegs gleiche Mengen von den anomeren Formen der D-Glucose. In wässriger Lösung
bilden sich 64 % b-D-Glucose und 36 % a-D-Glucose.
Warum wird - wie wir gesehen haben - nur durch Änderungen des Lösemittels jeweils ein anderes Anomeres gebildet?
Und warum entsteht in Wasser ein Anomerengemisch?
Zunächst zur räumlichen Anordnung der Ringsubstituenten. Als energetisch besonders günstig und damit bildungsfreudig sollten sich jene Moleküle erweisen, deren Hydroxylgruppen die größten Abstände zueinander besitzen. Die Gruppen können entweder senkrecht zur Ringebene (man sagt auch: axial) oder horizontal (äquatorial) stehen.
Betrachten wir noch einmal das Bild 2: Die beiden Hydroxylgruppen an den C-Atomen 1 und 2 der b-D-Glucose stören sich weniger als die bei der a-D-Glucose, die ja wohl deshalb nur zu 36 % vorliegt. Es ist also zu erwarten, dass sich immer das all-äquatoriale b-Anomere anreichert. Das ist aber nicht bei jedem Lösemittel der Fall – wie wir gesehen haben!
Die Erklärung hierfür ist nicht einfach. Man muss dazu auch den Ringsauerstoff sowie dessen nichtbindende Elektronenpaare mit einbeziehen.
In Bild 7 zeigen wir die Newman-Projektion der beiden Formen.
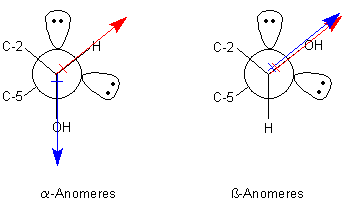
Bild 7: Newman-Projektion der beiden Anomere von D-Glucose. Wir blicken vom C-Atom 1 auf die C-1-O-C-5-Achse.Die große Kugel symbolisiert das Sauerstoff-Ringatom. Eingezeichnet sind auch dessen zwei nichtbindende Elektronenpaare
In Bild 7 sind auch die intramolekular wirksamen Dipole eingezeichnet. Der Dipolvektor der OH-Gruppe am C-Atom 1 ist blau markiert. Der resultierende Dipolvektor der beiden nichtbindenden Orbitale des Ringsauerstoffatoms ist rot gezeichnet. Die Darstellung ist schematisch; deshalb sagt die Länge der Pfeile nichts über die Größe des jeweiligen Dipolmoments aus. Diese Dipole stehen nicht für sich isoliert da, sondern unterliegen einer Wechselwirkung. Man spricht vom anomeren Effekt.
Beim a-Anomeren stehen die Dipole nahezu gegenüber und kompensieren sich weitgehend, was zu einem Energieminimum führt.
Beim b-Anomeren zeigen die Dipole in die gleiche Richtung und stören sich elektrostatisch, was zu einer Energieerhöhung führt.
Der anomere Effekt wirkt sich also stärker aus als der sterische Effekt, den wir zuvor beschrieben haben.
Der Energieunterschied zwischen den beiden Anomeren ist mit 1 kJ/Mol allerdings ziemlich gering. Deshalb sind im Gleichgewichtszustand in wässriger Lösung beide anomere Formen der D-Glucose nebeneinander zumindest in gleicher Größenordnung vorhanden.
Aber warum überhaupt ist dann die b-D-Glucose
in wässriger Lösung in der Überzahl?
Das sollte doch genau andersrum sein! Denn die b-D-Glucose ist doch energetisch benachteiligt.
Der Grund, dass das nicht so ist, liegt darin, dass beim b-Anomeren die starken Dipolmoleküle des Wassers von außen her das wirksame intramolekulare Dipolmoment stark abschwächen. Somit tritt wieder der potentialsenkende räumliche Effekt der all-äquatorial-Anordnung der OH-Gruppen in den Vordergrund. Resultat: In wässriger Lösung ist die Bildung der b-D-Glucose bevorzugt.
In weniger polaren Lösemitteln wie Ethanol oder Dimethylformamid (DMF) gibt es bei der b-D-Glucose keine Abschwächung des wirksamen Dipolmoments. Hier liegt deshalb quantitativ die a-D-Glucose vor, die dann beim Abdampfen des Lösemittels auch entsprechende Kristallgitter bildet.
Und wie wirkt das Pyridin, das ja zur quantitativen Bildung von b-D-Glucose führt?
Diese bei Raumtemperatur flüssige aromatische Stickstoffbase ist nicht nur Lösemittel, sondern wirkt dazu noch katalytisch,
indem sie zunächst einmal als Base die Mutarotation deutlich beschleunigt.
Sie bildet außerdem einen Molekülkomplex mit der Glucose, wobei durch sterische Effekte sowie durch chemische Wechselwirkung
zwischen dem intermediär gebildeten offenkettigen Aldehyd in C-1 und der Stickstoffbase des aromatischen Rings die
b-Form bevorzugt wird.
Es handelt sich hierbei letztlich um eine Art Modell des aktiven Zentrums eines enzymatisch
aktiven Proteins. Man spricht von kooperativer Katalyse.
Aber das ist schon wieder ein anderes Thema…
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 08. Januar 2012, Dagmar Wiechoczek