
Versuch: Untersuchen von Aspirin®
Schülerversuch; 15 min.
Beim Experimentieren den Allgemeinen Warnhinweis unbedingt beachten.
Geräte
2 Bechergläser (100 ml), Filtriervorrichtung, Tropfpipetten, Dreifuß, Bunsenbrenner.
Chemikalien
Universalindikatorpapier, Eisen(III)-chlorid-Lösung (Xn), Natronlauge (w = 10 %; C),
konzentrierte Salzsäure (C).
Durchführung
a) Eine Tablette Aspirin® wird in Wasser gelöst.
Die Lösung wird filtriert und mit Indikatorpapier und einer
wässrigen Eisen(III)-chlorid-Lösung geprüft.
b) In einem Becherglas wird eine Aspirin®-Tablette einige Minuten in 10 ml einer 10%igen Natronlauge gekocht (Schutzbrille!). Die Lösung lässt man abkühlen und filtriert sie anschließend. Das Filtrat wird mit konzentrierter Salzsäure tropfenweise angesäuert (mit Indikatorpapier prüfen). Zu der ausflockenden Mischung gibt man tropfenweise wässrige Eisen(III)-chlorid-Lösung.
Beobachtung
a) Die Lösung reagiert schwach sauer. Mit Eisen(III)-chlorid zeigt
sich keine deutliche Farbänderung. Die Lösung färbt sich, ähnlich der Lösung des Nachweisreagenzes,
bräunlich.
b) Bei Zugabe von Eisen(III)-chlorid-Lösung färbt sich die Probe rotviolett.

(Foto: Daggi)
Auswertung
Aspirin® (Acetylsalicylsäure) ist ein Ester aus
Essigsäure und Salicylsäure:
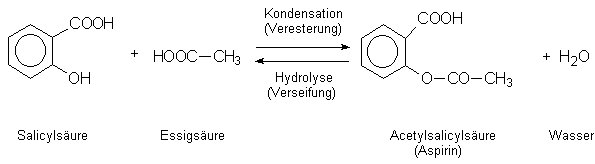
Aufgrund der Carboxylgruppe reagiert der Ester sauer. Wird er durch Kochen mit Natronlauge hydrolysiert, entstehen die Ausgangsprodukte Essigsäure und Salicylsäure. Letztere kann man mit Eisen(III)-chlorid-Lösung nachweisen.
Zur genaueren Untersuchung von Aspirin (vor allem im Vergleich zu seinem Analogen Paracetamol)
klicke hier.
Die Synthese von Aspirin beschreiben wir hier.
Literatur
R. Blume und Kollegen, Chemie für Gymnasien, Organische Chemie
Themenheft 3, Cornelsen Verlag, Berlin 1994, 19.