Prof. Blumes Tipp des Monats Mai 2003 (Tipp-Nr. 71)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Achtung: Aspirin ® und Paracetamol ® sind geschützte Namen und dürfen nicht ohne weiteres verwendet werden.
Rechtzeitig zur Maibowle
Bunte Farben aus weißen Pulvern
Aspirin ® und Paracetamol ® im chemischen Vergleich
Es ist wieder so weit: Nach extensivem Genuss des Naturprodukts Maibowle hat man Kopfschmerzen. Da hilft nur die "Chemie": Man greift nach dem Schächtelchen mit dem Aspirin. Und wenn man im kühlen Maienlüftchen zu lange draußen gesessen ist und sich dabei eine kräftige Erkältung zugezogen hat, reicht es nicht aus, eifrig Vitamin C zu schlucken oder heißen Zitronensaft zu trinken: Dann ist Paracetamol als Fiebersenker gefragt.
Und gefragt hat auch ein Schüler - erst sich und dann mich: Er habe in seiner Facharbeit folgende Aufgabe zu lösen: "Was ist der chemische Unterschied zwischen Aspirin und Paracetamol?"
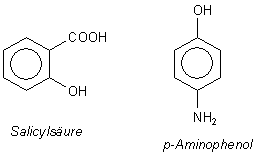
Was sind das für Substanzen? Zeichnen wir einmal die beiden Strukturformeln nebeneinander.

Aus den Strukturformeln leiten wir zunächst die chemischen Namen her:
Aspirin ist Acetylsalicylsäure (abgekürzt: ASS).
Paracetamol ist 4-Hydroxy-N-acetyl-amino-benzol oder 4-Hydroxy-acetyl-anilid.
(Zur Herkunft der Bezeichnung Aspirin klicke hier.)
Beim Betrachten der beiden Formeln sehen wir, wie wir zur vergleichenden Untersuchung experimentell vorgehen müssen.
Eine Vorbemerkung
Die Medikamente werden in unterschiedlichen Zubereitungen angeboten. Am besten
ist es, wenn man Tabletten nimmt, die keinen Lacküberzug haben. Auch Zäpfchen
sind ungeeignet. Natürlich verwendet man für die folgenden Versuche auch keine
stofflichen Mischungen wie Aspirin Plus (Ascorbinsäure).
Befassen wir uns zunächst mit den freien funktionellen Gruppen
Beim Aspirin handelt es sich um eine Carbonsäure, beim Paracetamol um ein Phenol.
Carbonsäuren wirken stärker sauer als Phenole.
|
Versuch 1: Messen des pH-Werts der Lösungen
|
Aspirin reagiert in Lösung mit pH = 2,75 stärker sauer, Paracetamol mit pH = 6,80 fast neutral.
Nun geht es um die phenolischen Funktionen
Beim Aspirin handelt es sich um ein verdecktes Phenol, bei Paracetamol um ein offenes.
Eisen(III) reagiert mit Phenolen zu blau bis violetten komplexen Farbstoffen. (Was
Komplexverbindungen sind und alles Wichtige über ihren Aufbau erfahren Sie auf
unserer Spezial-Webseiten-Gruppe zur Komplexchemie.)
|
Versuch 2: Nachweis des phenolischen Charakters
|
Wie erwartet bildet Aspirin mit Eisen(III)-Ionen keinen Komplex. Eventuell ist eine geringe Farbvertiefung der gelben Lösung zu erkennen. Mit Paracetamol erhalten wir einen tiefblauen Komplex.

Bild 1: Komplex des Paracetamols mit FeCl3
(Foto: Daggi)
In beiden Stoffen ist Essigsäure gebunden
Einmal als Phenolester und das andere Mal als Säureamid, genau als Anilid. (Zur Synthese von
Aspirin klicke hier.) In unserer Webseite zur
Untersuchung von Aspirin haben wir die
Essigsäure mit 10%iger Natronlauge abgespalten. Wenn wir die Reaktionsmischung
dann kräftig mit Salzsäure ansäuern, muss es nach Essigsäure riechen. Das versuchen
wir hier auch.
|
Versuch 3: Alkalische Hydrolyse der beiden Medikamente
|
In diesem Zusammenhang ist auch zu verstehen, warum Schmerztabletten mit Acetylsalicylsäure, die nach Essig riechen, nicht mehr verwendet werden sollten. Die waren offensichtlich großer Wärme und Feuchtigkeit ausgesetzt gewesen. Es wird nicht nur die Wirkung beeinträchtigt, sondern es entstehen auch den Magen schädigende phenolische Abbauprodukte. Betroffen davon sind vor allem die im Ausland oftmals erhältlichen Tabletten in Glasflaschen. Haltbarer sind die Tabletten, die in Folien ("Blister") eingeschweißt worden sind.
Der deutliche Geruch nach Essigsäure zeigt, dass beide Medikamente gebundene Essigsäure tragen. Aus Aspirin entsteht Salicylsäure. Aus Paracetamol sollte p-Aminophenol entstehen.
Leider ist bei der alkalischen Hydrolyse von Paracetamol die Lösung dunkelbraun, ja fast schwarz geworden. Grund: Es entsteht nicht das gewünschte p-Aminophenol, sondern in diesem Milieu durch Oxidation mit Luftsauerstoff sofort eine gelbbraune Verbindung mit chinoider Struktur.
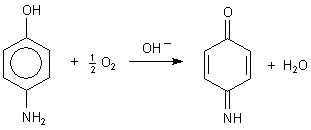
Oxidation von p-Aminophenol
Diese Verbindung bildet dunkelfarbige Polymere. Es resultiert insgesamt eine schwarzbraune Brühe, mit der man nicht weiter experimentieren kann.

Bild 2: Produkt der alkalischen Hydrolyse von Paracetamol
(Foto: Daggi)
Deshalb kann man den folgenden Versuch nur mit Salicylsäure machen.
|
Versuch 4: Nachweis des phenolischen Charakters der Hydrolyseprodukte
|
Es gibt einen rotvioletten Farbkomplex, weil jetzt ein Phenol entstanden ist. Wenn die Lösungen zu dunkel gefärbt sind, muss man sie mit destilliertem Wasser verdünnen.

Bild 3: Komplex des hydrolysierten Aspirins mit FeCl3
(Foto: Daggi)
Um auch die Untersuchung von Paracetamol zu ermöglichen, wenden wir die saure Hydrolyse
an.
|
Versuch 5: Saure Hydrolyse der Medikamente
|
Es riecht in beiden Fällen deutlich nach Essigsäure. Diesmal findet keine Oxidation statt, weil das p-Aminophenol im sauren Bereich gegenüber Sauerstoff stabil ist. Außerdem ist die Lösung des Paracetamols hellgelb geworden, die des Aspirins ist dagegen farblos geblieben. Zu der Eisen(III)-chlorid-Probe: Beim Hydrolyseprodukt des Aspirins wird die Lösung wie bei Versuch 4 wieder rotviolett, bei dem Hydrolyseprodukt von Paracetamol diesmal lilafarben.
Mit p-Aminophenol kann man Farbstoffe synthetisieren
Das aus dem Paracetamol entstandene p-Aminophenol ist ein reizvoller Stoff. Mit dem
können wir zum Beispiel eine Azokupplung versuchen. Wir
verwenden das Reaktionssystem des Nitrit- bzw. NOx-Nachweises mit Saltzmans
Reagenz. p-Aminophenol ersetzt hier die Sulfanilsäure. Die
Hydrolyselösung aus Versuch 5 ist dazu sauer genug, muss also (wie in der Vorschrift
angegeben) nicht mit Essigsäure angesäuert werden.
|
Versuch 6: Azosynthese mit dem Hydrolyseprodukt von Paracetamol
|
Es bildet sich wie beim Nitritnachweis rasch ein roter Farbstoff. Das spricht dafür,
dass es sich bei dem Hydrolyseprodukt von Paracetamol tatsächlich um ein
aromatisches Amin handelt. Wir können p-Aminophenol auch als ein Anilinderivat
auffassen: p-Hydroxyanilin. Anilin ist seit Runges Untersuchungen ein wichtiger Stoff
für Farbensynthesen.
Ein Hinweis: Es handelt sich um den gleichen Reaktionsablauf wie bei Saltzmans
Reagenz, nur dass die Sulfanilsäure hier durch p-Aminophenol ersetzt wird.
p-Aminophenol ist ein Reduktionsmittel
Wir erinnern uns daran, dass in Versuch 3 bei der alkalischen Hydrolyse von
Paracetamol statt des p-Aminophenols durch Oxidation chinonartige Substanzen
entstanden. Kann man die reduzierende Wirkung von p-Aminophenol in einem
"sauberen" Versuch zeigen?
|
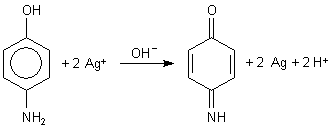
Versuch 7: Reduzierende Eigenschaften von p-Aminophenol
|
Es bildet sich rasch ein feiner schwarzer Niederschlag von Silber. Das kennen wir - von den Entwicklern im photographischen Prozess. Und tatsächlich gehört p-Aminophenol zu den Entwicklern. Sein weichzeichnendes Derivat p-N-Methyl-aminophenol ist zum Beispiel unter dem Handelsnamen Metol bekannt.
Hier sind noch einmal alle Farben, die man mit Paracetamol zaubern kann.

Bild 4: Reaktionsergebnisse mit Paracetamol und seinem Hydrolyseprodukt
Von links: (1) Saure Hydrolyselösung, (2) Farbbildung nach Diazotierung, (3) Paracetamol
+ FeCl3-Lösung,
(4) p-Aminophenol + FeCl3-Lösung, (5) Zusatz von Silbernitratlösung/Ammoniak
(Foto: Daggi)
Toll, was für chemische Experimente man mit diesen beiden Medikamenten aus dem häuslichen Apothekenschrank machen kann. Stimmt's?
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 27. April 2014, Dagmar Wiechoczek