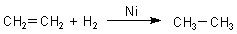
Die heterogene Katalysatorwirkung ist anisotrop
Experimente:
Versuch: Oszillationen bei der Oxidation von Methanol mit Platinnetz
Versuch: Oxidation von Alkoholen und Ketonen an Kupferdraht
Versuch: Substratspezifität der Urease
Wenn man die Wirkung von Festkörperkatalysatoren genau untersucht, so stellt man
fest, dass nicht die gesamte Oberfläche am Katalyseprozess beteiligt ist, sondern nur
einzelne Bereiche teilnehmen. Das erkennt man zum Beispiel am Oszillieren der Glut
bei der Oxidation von heißem Methanoldampf am Platinkontakt (->
Versuch). Aber auch die Reaktion von Acetondampf mit
Sauerstoff und der Kupferspirale ist hier zu nennen (-> Versuch).
Auch in der Technik sind solche Reaktionen bekannt. Ein Beispiel ist die durch ein Metall wie Nickel
katalysierte Hydrierung von Ethen.
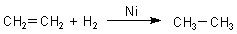
Der Grund liegt im feinkristallinen Aufbau der Kontaktmasse. Eine wichtige Eigenschaft der Kristalle ist nämlich ihre Anisotropie. Darunter versteht man, dass viele Eigenschaften der Kristalle von der Richtung abhängen, in der sie auf die Kristalloberfläche einwirken oder von ihr ausgehen. Beispiele sind beim Graphit die Ritzhärte, die Reflexion von Licht, der Glanz oder die elektrische Leitfähigkeit. (Zur Anisotropie lies das Kapitel in unserer Kristallwebseite.)
Voraussetzung für die Katalyse ist im Allgemeinen eine Mehrpunktadsorption der Reaktanden. Man muss wissen, dass einige Kristallflächen dichter mit Metallatomen belegt sind als die anderen. Ein Molekül wie das Ethen würde bei der Adsorption an die eine Fläche fester gebunden als an die andere, weniger Atome enthaltene Fläche. Es müsste sich im zweiten Fall förmlich strecken. Damit ist auch seine Energie größer, die Reaktion mit Wasserstoff läuft deshalb schneller. Folglich sind die Flächen katalytisch unterschiedlich wirksam. Wir sehen, dass dies auch Einfluss auf die Selektivität von Katalysatoren haben muss.
Hinzu kommt noch, dass auch nur bestimmte Teile der Kristalle eine Rolle spielen.
Hier geht es vor allem um Kanten und Spitzen, die für die Reaktionsbeschleunigung
infrage kommen. Diese werden besonders leicht von Fremdstoffen wie Schwefel- oder
Arsenverbindungen besetzt, die dann als Katalysatorgifte wirken.
Beachten muss man auch, dass die Kristalle nicht zusammenwachsen dürfen, weil sie
dann einen Teil ihrer aktiven Oberfläche verlieren. Aus diesem Grunde gibt man
Substanzen zum Verhindern des Zusammenwachsens zu.
Ein Beispiel: Feinverteiltes Eisen ist Katalysator bei der Ammoniaksynthese. Allein ist
aber weniger wirksam als wenn man es mit Aluminiumoxid mischt. So können Stoffe
die katalytische Wirkung verstärken, ohne selbst am chemischen Vorgang
teilzunehmen. Man spricht hier von Aktivatoren, das System nennt man
Mischkatalysator. Gleiches gilt für den Autoabgas-Katalysator. Das keramische
Material hat auch die Eigenschaft, die Gase länger zu absorbieren.
Wenn man das weiß, so kann man in dem einen oder anderen Fall die Kristalle des Katalysators so züchten oder in ihrem Wachstum beeinflussen, dass ihre katalytisch wirksamsten Oberflächen besonders groß werden. Dies versucht man in letzter Zeit beim Platin, das als Katalysator bei den Brennstoffzellen von größter Bedeutung ist.
Wichtig ist, dass die Adsorption der Edukte oder Produkte am Kontakt nicht zu stark sein darf. Dann erfordert die Ablösung eine zu hohe Energie, die die Rückreaktion zur Folge haben kann.
Besonders bei der Enzymkatalyse finden wir solche auf geometrischen Strukturen beruhende Selektivität, die dort im Allgemeinen wie bei der Urease 100 % beträgt (-> Versuch). Man spricht hier gern vom "Schlüssel-Schloss-Prinzip".
Weitere Texte zum Thema „Katalyse“