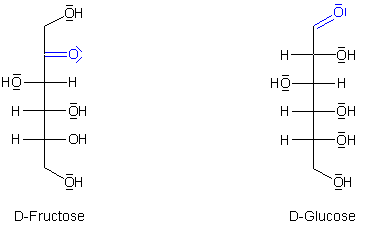
Kohlenhydrate sind Polyhydroxyl-Carbonyl-Verbindungen
Experimente:
Versuch: Fehling-Reaktion mit Mono- und Disacchariden
Kohlenhydrate sind wohl die bekanntesten Verbindungen der Biochemie und die bedeutendsten
der organischen Welt. Ihr Verbreitungsgebiet reicht vom einfachen Energie liefernden Stoffwechselprodukt
Glucose bis hin zur Desoxyribose, dem in der hochspezialisierten DNA enthaltenen Zucker.
Die meisten Menschen denken bei dem Wort Kohlenhydrat aber immer zuerst an Frucht- oder Traubenzucker, auch bekannt unter den Bezeichnungen „Fructose“ und „Glucose“. Betrachten wir die Struktur der beiden Verbindungen.
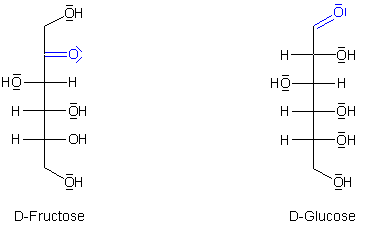
Fructose und Glucose im Vergleich
Es ist deutlich zu erkennen, dass sowohl die Fructose als auch die Glucose über
eine Carbonylgruppe verfügen. Es gibt aber einen Unterschied: Bei
der Fructose handelt es sich um ein Keton und bei der Glucose um einen Aldehyd.
Ist das offenkettige Kohlenhydrat ein Aldehyd, so nennt man es Aldose.
Handelt es sich um ein Keton, so spricht man von einer Ketose.
Kohlenhydrate tragen dazu auch noch viele alkoholische Hydroxylgruppen.
Welche Eigenschaften haben die Kohlenhydrate mit
den Carbonylverbindungen gemeinsam?
Um diese Frage zu beantworten, muss man sich mit einigen Besonderheiten dieser Stoffklasse
auseinandersetzen. Die Carbonylfunktion ist eine
hoch reaktive funktionelle Gruppe. Besonders die Aldehydgruppe zeichnet sich durch ihre leichte
Oxidierbarkeit aus. Hinzu kommen die Reduzierbarkeit zum Alkohol und der leichte nucleophile
Angriff am Kohlenstoffatom der Carbonylgruppe. Hinzu kommen noch Wechselwirkungen zwischen
benachbarten Carbonyl- und Hydroxylgruppen, die Grundlagen für die typische Chemie der Kohlenhydrate
sind.
Wie kommt es zur Ringstruktur der Kohlenhydrate?
Carbonylgruppen reagieren mit Hydroxylgruppen unter Bildung von Halbacetalen.
Nun besitzen Kohlenhydrate sowohl eine Carbonylgruppe als auch Alkoholgruppen. Deshalb können sie sogar intramolekular
Halbacetale bilden.
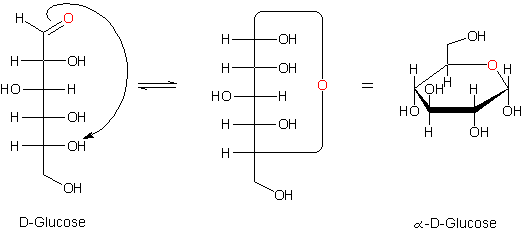
Gleichgewicht zwischen der offenen und der cyclischen Form der Glucose
Die links gezeichneten Strukturen sind Fischer-Projektionen. Ihr Mangel wird offensichtlich, wenn man die viel zu langen Bindungen des Sauerstoffatoms betrachtet. Dagegen zeigt die rechts gezeichnete Struktur eine Projektion, die den tatsächlichen Verhältnissen viel näher kommt. Diese Ringstruktur wird auch nach dem englischen Chemiker und Nobelpreisträger (1937) W. N. Haworth benannt: Haworth-Ring oder Haworth-Projektion.
Offene Kettenformen und Ringformen stehen in einem chemischen Gleichgewicht. Der Ring kann leicht wieder geöffnet werden – zum Beispiel in schwach-alkalischem Milieu, wozu schon eine verdünnte Sodalösung ausreicht. Das ist einer der Gründe dafür, weshalb alle klassischen Reduktionsproben auf Kohlenhydrate (wie mit Fehlings Reagenz oder Bendedict-Lösung) in alkalischem Milieu ablaufen müssen.
Weiteres zu den Ringstrukturen siehe hier.
Ein weiteres Indiz für eine Carbonylgruppe - Die
reduzierende Wirkung mancher Zucker
Aldehyde wirken reduzierend, da sie in der Lage
sind, Carbonsäuren zu bilden. Deshalb können sie auch mit Hilfe von Fehlingscher Lösung
nachgewiesen werden. Diese Reaktion zeigen Zucker immer dann, wenn sich die offenkettige
Form bilden kann und diese über eine Aldehydgruppe verfügt. Ein Beispiel hierfür ist die
Glucose. Bei einer Oxidation dieser Aldehydgruppe entsteht eine Carboxylgruppe R-COOH. Die
Substanz ist eine Zucker-Säure, eine –onsäure. Bei der Glucose ist es die
Gluconsäure, die z. B. im Honig vorkommt. Die ist nicht zu
verwechseln mit einem am C-Atom 6 oxidierten Kohlenhydrat, einer –uronsäure. Beispiel:
Galacturonsäure. Die ist typisch für schleimbildende Polysaccharide.
Einfach Ketone dagegen wirken per se nicht reduzierend, da sie ohne aufwendiges Zerbrechen ihrer C-C-Bindungen keine Säuren bilden können. Da sich aber ein chemisches Gleichgewicht ausbildet, bei dem Ketosen in Aldosen übergehen, gibt es doch die Möglichkeit, sie in alkalischem Milieu zu oxidieren. Fructose reagiert deshalb ebenfalls mit Fehlings Reagenz.
Von der Ketose zur Aldose mittels Keto-Enol-Tautomerie
Die offene Form der Aldose wirkt reduzierend. Als Keton sollte das bei der Ketose nicht der
Fall sein. Wie aber ist es zu erklären, dass Ketosen doch mittels Fehlingscher Lösung nachgewiesen
werden können, obwohl der Nachweis auf der reduzierenden Wirkung beruht? Mit der Ketose muss also
eine Umwandlung stattgefunden haben.
Wir wissen, dass die offene Form der Ketosen ein Keton ist. Eine Eigenschaft von Ketonen ist die Keto-Enol-Tautomerie. Daraus resultiert eine wichtige Umlagerungsreaktion der Zucker, die Lobry de Bruyn-van Ekenstein- Umlagerung.
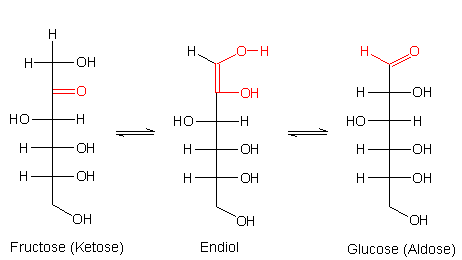
Die Lobry de Bruyn-van Ekenstein-Umlagerung von Fructose zu Glucose
Aus der Fructose bildet sich also Glucose. Diese lässt sich über ihre reduzierende Wirkung mittels Fehlingscher Lösung nachweisen. Genau genommen gilt das auch schon für die Endiol-Zwischenstufe, die der äußerst reaktiven Endiolgruppe der Ascorbinsäure entspricht. Da diese Umlagerung Zeit benötigt, läuft die Fehling-Reaktion mit Fructose deutlich langsamer ab als die mit Glucose.
Nicht dargestellt ist hier die Möglichkeit zur Bildung eines dritten Zuckers, der Mannose. Bei ihr steht die OH-Gruppe auf der linken Seite – verglichen mit der Glucose.
Weiteres zur Umlagerung siehe hier.
Weitere Texte zum Thema „Kohlenhydrate“