 |
| Bild 1: Cer(IV)-nitrat-Lösung mit Ethanol (links) und Wasser (rechts) |
| (Foto: Sandra) |
Komplexe in der organischen Analytik
Experimente:
Versuch: Alkoholnachweis mit Cer(IV)-nitrat
Versuch: Nachweis von Glucose mit Fehling-Reagenz
Versuch: Vereinfachte Biuretprobe
Auch in der Analyse von organischen Stoffen spielen Komplexe eine Rolle. Einige dieser Reaktionen
sind aus der Schulchemie bekannt.
Alkoholnachweis mit Cerammonium-Reagenz
Zum Beispiel lässt sich Alkohol durch die Zugabe von Cer(IV)-ammoniumnitrat in einen
tiefroten Komplex überführen (-> Versuch).
 |
| Bild 1: Cer(IV)-nitrat-Lösung mit Ethanol (links) und Wasser (rechts) |
| (Foto: Sandra) |
Dieser hat ein Cer(IV)-Ion als Zentralteilchen und Alkoholmoleküle als Liganden. Der Komplex
ist allerdings wenig stabil, da Ce4+-Ionen den Alkohol oxidieren.
Näheres dazu kann man auf einer besonderen Webseite nachlesen.
Aldehydnachweis mittels Fehlingscher Lösung
Ein sehr wichtiges Nachweisreagenz auf der Basis einer Komplexverbindung ist die Fehlingsche
Lösung. Sie wird hauptsächlich genutzt, um reduzierende Stoffe wie z. B.
Aldehyde oder reduzierende Zucker nachzuweisen (-> Versuch).
Es ist schon lange bekannt, dass Aldehyde Kupfer(II)-Ionen reduzieren.
R-CHO + Cu2+ + H2O
![]() R-COOH + Cu+ + H+
R-COOH + Cu+ + H+
Das Problem ist, dass diese Reaktion zur Gleichgewichtsverschiebung alkalisches Milieu erforderlich macht. Unter diesen Bedingungen bildet sich aber zunächst Kupfer(II)-hydroxid, das als Festkörper nicht mit dem Aldehyd reagiert. Deshalb muss man das Kupfer(II)-Ion durch Komplexbildung in Lösung halten. Das geschieht durch Zugabe von Kaliumnatriumtartrat, ein unter der Bezeichnung Seignettesalz bekanntes Salz der Weinsäure. Es bildet sich der tiefblaue Di-tartrato-cuprat(II)-Komplex, der ähnlich oxidierend wirkt wie das Cu2+-Ion.
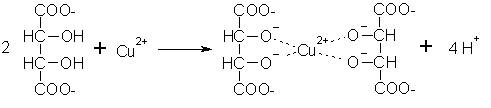
Mit Kupfer(I)-Ionen bildet sich dieser Komplex nicht, so dass als Reaktionsprodukt gelb-rotes
Kupfer(I)-hydroxid ausfällt.
Die Fehling-Lösung setzt man erst kurz vor dem Experiment
aus zwei Lösungen zusammen. Fehling I bezeichnet die reine Kupfer(II)-sulfat-Lösung, Fehling II
enthält das Seignettesalz und Natronlauge. Der Grund ist, dass der Ditartratocuprat(II)-Komplex
nicht allzu stabil ist, weil mit der Zeit auch die Weinsäure durch Cu2+-Ionen oxidiert wird.
Statt Seignettesalz und Natronlauge kann man zum Komplexieren auch Citrat und Sodalösung nehmen.
Dieses Benedict-Reagenz ist im Gegensatz zur Fehling-Lösung stabil.
 |
| Bild 2: Verdünnte Fehlinglösung (rechts) und nach Erwärmen mit Glucoselösung (links) |
| (Foto: Sandra) |
Die Biuretprobe
Die Biuretprobe ist die klassische Nachweisreaktion auf Harnstoff.
Biuret bildet sich aus zwei Harnstoffmolekülen durch Erwärmen unter Ammoniakabspaltung:
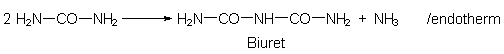
Bei der Nachweisreaktion handelt es sich um eine Komplexbildung mit Kupfer-Ionen.
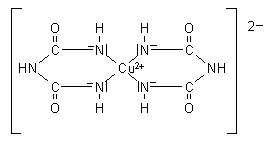
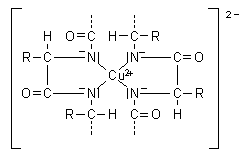
Es bildet sich eine schöne typisch purpurrote Farbe aus. Da die Reaktion im stark alkalischen Milieu durchgeführt wird, benötigt man zur Bereitung von Biuretreagenz auch hier stabilisierende Komplexbildner wie Seignettesalz. Man kann allerdings auch auf deren Zusatz verzichten. Es reicht nämlich aus, nur Kupfersulfatlösungen zu den alkalisch eingestellten Proteinlösungen zu geben. Denn der sich sofort bildende Chelatkomplex schützt die Kupfer(II)-Ionen vor der Ausfällung als Hydroxid (-> Versuch).
Da Biuret eine gewisse Ähnlichkeit mit der Peptidbindung in Proteinen aufweist, funktioniert die Biuretprobe auch als Nachweis für lösliche Proteine.
Weitere Texte zum Thema „Komplexverbindungen“