
Giftige Stickstoffverbindungen in Lebensmitteln
Obwohl Stickstoffverbindungen für das Leben unbedingt notwendig sind, gibt es eine Reihe Einschränkungen.
Ammonium
Hierzu haben wir eine besondere Webseite.
Nitrit und Nitrat
Nitrit ist sogar in der E-Liste aufgeführt, ist also
als Lebensmittelzusatz zugelassen. Hier spielt es bei der Konservierung von empfindlichen
Lebensmitteln eine Rolle.
Das klassische Konservierungsverfahren ist das Pökeln. Nitritpökelsalz enthält heute neben
Natriumchlorid ca. 0,5 % Natriumnitrit NaNO2 und zusätzlich eine größere (1-2 %)
Menge an Kaliumnitrat KNO3. In Rohschinken findet man leicht 150 mg/kg NaNO2
und 300-600 mg/kg KNO3. Aus dem Nitrat wird durch Bakterien unter reduzierenden
Bedingungen Nitrit gebildet. Es stellt somit eine Nitritreserve dar.
Zwei Wirkungsmechanismen sind beim Nitrit von Bedeutung:
1 Umrötung des Fleisches
Rotes, instabiles Myoglobin (Mb) wird vor allem durch Erhitzen bei Sauerstoffanwesenheit zu
grauem MetMb oxidiert (Farbe von hausgemachter Leberwurst):

Der stattdessen gebildete, ebenfalls tiefrote NO-Komplex ist dagegen hitzestabil:
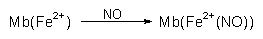
2 Clostridien-Hemmung
Nitrit hemmt ganz besonders anaerobe Bakterien und damit auch den gefürchteten Auslöser der
Lebensmittelvergiftung, Clostridium botulinum. Wegen dieser Hemmung setzt man Nitrit
auch dem Schnittkäse beim Reifen zu, um Fehlgärungen zu verhindern.
Nitrit ist physiologisch keineswegs unbedenklich
Auch wenn es in vielen Lebensmitteln enthalten ist, sollte man davon möglichst wenig aufnehmen.
Die Grenzwerte sind bei Nitrit 0,1 mg/l und bei Nitrat 50 mg/l.
Nitrit und Nitrat sind gesundheitlich bedenklich, weil sie direkt oder indirekt das Blut angreifen und auch sonst viele Enzyme hemmen. Kinder, die zuviel Nitrat oder Nitrit im Trinkwasser haben, bekommen eine blaue Gesichtsfarbe; sie leiden unter Atemnot. Außerdem leiden Kleinkinder wegen der hohen Salzfracht des Trinkwassers leicht an Durchfall.
1 Komplexbildung und Oxidation von Hämoglobin
Es greift u. a. das dem Myoglobin chemisch ähnliche Hämoglobin (Hb) an. Ab 0,5 g/kg KNO2
Körpergewicht beobachtet man deshalb auch bei Erwachsenen Methämoglobinämie. Bei Kleinkindern tritt diese
Störung schon bei wesentlich geringeren Konzentrationen ein, da deren fetales Hb (FHb) wesentlich leichter
oxidierbar ist.
2 Stickstoffeliminierung durch Nitrit
Nitrit-Ionen eliminieren bei primären Aminen Stickstoff. Dazu ist schwach saures Milieu notwendig.
Diese Reaktion ist letztlich eine Diazotierung.
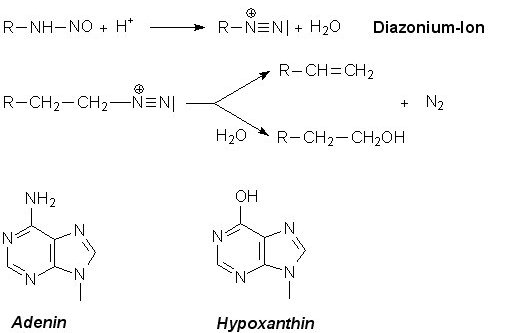
Das Diazonium-Salz ist nicht stabil; es zerfällt unter Abgabe von Stickstoff. In wässrigem Milieu entsteht so aus dem Amin ein Alkohol. Wenn davon die DNA getroffen wird, gibt es eine Mutation.
3 Bildung von Nitrosaminen
Beim Erhitzen von sekundären oder tertiären Aminen mit Nitrit in saurem Milieu bilden sich cancerogene
Nitrosamine:
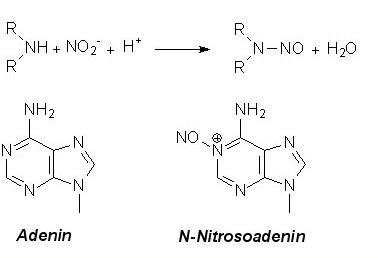
Auch hier kann es zu Schäden am Erbgut kommen - mit der Folge von Krebs oder Mutationen.
Eine typische Speise mit hohem Potential zur Bildung von Nitrosaminen ist der "Toast Hawaii": Für Amine sorgen die Proteine und anderen Inhaltsstoffe von Käse und Schinken. Letzterer ist für den Eintrag von Nitrit verantwortlich. Das saure Milieu stammt von der Ananasscheibe.
Fischwaren dürfen überhaupt nicht mit Nitrit behandelt werden, da sie besonders viel biogene Amine ("Geruch nach Fisch") enthalten.
Acrylamid
Acrylamid bildet sich beim Erhitzen von Biomasse aus der Aminosäure Asparagin. Zwischen den beiden
besteht eine starke strukturelle Ähnlichkeit.
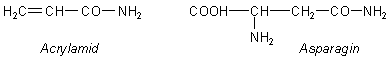
Allerdings reicht es nicht aus, Asparagin allein zu zersetzen. Man weiß, dass Stärke bzw. Glucose daran beteiligt sind. Es bilden sich komplizierte zyklische Übergangsverbindungen zwischen den Kohlenhydraten und dem Asparagin aus, aus denen sich Acrylamid auch bei niederen Temperaturen bilden kann. Solche Abbaureaktionen sind unter dem Begriff Maillard-Reaktionen bekannt.
Weitere Texte zum Thema „Ammoniak, Amine und Säure-Amide“