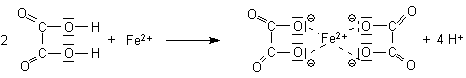
Oxalsäure als Komplexbildner
Experimente:
Versuch: Entrosten mit Oxalsäure oder Kleesalz
Versuch: Oxalsäure als Lösungsmittel für Rost
Versuch: Darstellung des Oxalatkomplexes Kalium-di-oxalato-ferrat(II)
Versuch: Das Prinzip von Blaupausen
Oxalsäure bzw. Oxalate sind bedeutende Komplex-Liganden.
Da sie mehrzähnig sind, handelt es sich um Chelate.
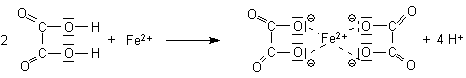
Di-oxalato-ferrat(II)-Komplex
Eisen/Oxalat-Komplexe heißen Oxalato-ferrate, da ihre Komplex-Ionen Anionen sind. Ein Beispiel ist das Kalium-di-oxalato-ferrat(II), das leicht hergestellt werden kann (-> Versuch):
K2[Fe(II)(ox)2]
Diese Tendenz zur Komplexbildung ist zunächst einmal die Grundlage für viele toxische Wirkungen der Oxalsäure und ihrer Salze. Die beruhen fast immer auf dem Einfang von Calcium- und anderen Ionen (-> Webseite). Andererseits gibt es aber auch andere Möglichkeiten, die Komplexbildung technisch zu nutzen.
Einige Beispiele für Anwendungen der Oxalsäurekomplexe
Oxalatblut zur Herstellung von Blutserum
Ähnlich wie Citrat (-> Citratblut) wirkt auch Oxalat bei der Verhinderung
der Blutgerinnung durch Einfang von Calcium-Ionen.
Entrosten von Eisen
Eisenhydroxid wird durch Oxalsäure zersetzt. Dabei bilden sich lösliche Komplexverbindungen.
Bildung von pyrophorem Eisen
Der Di-oxalato-ferrat(II)-Komplex K2[Fe(II)(ox)2] zersetzt sich in der Hitze in einer
intramolekularen Redoxreaktion zu Eisen und CO2.
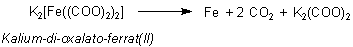
Dieses extrem fein verteilte Eisen reagiert bei Kontakt mit Luft sofort unter heftigem Aufglühen zu Eisenoxid, daher seine Bezeichnung „pyrophor“ (griech. pyr, Feuer und pherein, tragen).
K3[Fe(III)(ox)3] • 3 H2O
Es ist (wie auch das entsprechende Citrat) lichtempfindlich. Beim Belichten bildet sich in einer Redoxreaktion Eisen(II)-oxalat. Eisen(III)-Ionen wirken dabei als Oxidationsmittel.
Fe(III)2(ox)3 + Lichtenergie ———> 2 Fe(II)(ox) + 2 CO2
Die Eisen(II)-Ionen bilden mit dem in der Reaktionsmischung enthaltenem Roten Blutlaugensalz das cyanfarbene Berliner Blau.
Statt des Komplexes kann man auch lösliches Eisen(III)-oxalat Fe2(ox)3 • 6 H2O nehmen. Dieses ist ein gelbes Salz.
Zum Lichtpausverfahren haben wir eine besondere Webseite.
Eloxalverfahren
Das besonders gut wasserlösliche Ammonium- tri-oxalato-ferrat(III)
(NH4)3[Fe(III)(ox)3] • 3 H2O
dient zur elektrolytischen Oxidation von Aluminium (Eloxalverfahren). Mit ihm erhält man je nach Verdünnung gelbe, goldenfarbene oder braune Überzüge.