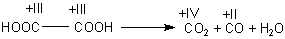
Zersetzungsreaktionen von Oxalsäure und Oxalaten
Experimente
Versuch: Zersetzen von Oxalsäure durch Erhitzen
Versuch: Zersetzen von Oxalsäure durch Schwefelsäure
Versuch: Erhitzen von Kalium-, Natrium- und Calciumoxalat
Versuch: Erhitzen von Ammoniumoxalat
Zersetzen durch Erhitzen
Beim Erhitzen zersetzt sich die Oxalsäure rückstandsfrei zu CO2, CO und
H2O mit Ameisensäure HCOOH als nachweisbarer Zwischenstufe.
HOOC-COOH + Energie ———> HCOOH + CO2
HCOOH + Energie ———> CO + H2O
Die Dämpfe brennen wie die Ameisensäure und wie CO mit bläulicher Flamme.
Ähnlich ist es bei den Salzen der Oxalsäure. Erhitzt man Kleesalz oder Kaliumoxalat, so
bleibt jedoch Pottasche zurück.
Beim Erhitzen von Natriumoxalat entsteht Soda, beim Erhitzen von Calciumoxalat Calciumcarbonat.
Erhitzt man dagegen Ammoniumoxalat, so verschwindet wieder alles restlos.
Zersetzen durch Schwefelsäure
Die gleichen Ergebnisse wie bei der thermischen Zersetzung erreicht man auch durch Behandlung
der Oxalsäure mit 60 °C heißer konzentrierter Schwefelsäure.
Fotochemische Zersetzung
Lösungen von Oxalsäure müssen in dunklen Flaschen aufbewahrt werden, denn sie sind lichtempfindlich.
Sie zersetzen sich unter Bildung von Gasen wie CO2 und CO. Deshalb können bei intensiver
Bestrahlung geschlossene Gefäße platzen. (Ähnliches beobachtet man auch bei der
Ameisensäure.)
Die Zersetzung von Oxalsäure ist ein Redox-Prozess
Die Zersetzungsreaktion findet auch statt, wenn kein Sauerstoff oder ein anderes Oxidationsmittel anwesend
ist. Schauen wir uns noch einmal die Gesamtgleichung an:
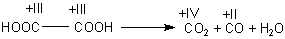
Wir erkennen anhand der Oxidationszahlen, dass es sich um eine intramolekulare Redoxreaktion handelt. Der Kohlenstoff wechselt seine Oxidationszahl von +(III) zu +(II) und +(IV), während Wasserstoff und Sauerstoff ihre Oxidationszahlen behalten. Hinsichtlich des Kohlenstoffs haben wir eine Disproportionierungsreaktion vorliegen.
Auf der rückstandsfreien Zersetzbarkeit und Reduktionskraft der Oxalsäure bzw. der Oxalat-Anionen beruht letztlich auch die Herstellung von pyrophorem Eisen durch Erhitzen von Eisen(II)-oxalat.
Weitere Texte zum Thema "Oxalsäure"