Darstellung von Formaldehyd durch Methanol-Oxidation
Experimente:
Versuch: Oszillationen bei der Oxidation von Methanol
mit Platinnetz
Versuch: Oxidation von Alkoholen und Ketonen an Kupferdraht
Versuch: Modellversuch zu Döbereiners Feuerzeug
Grundsätzliche Probleme bei der Oxidation von gut
brennbaren organischen Substanzen
Die begrenzte Oxidation von Stoffen wie den Kohlenwasserstoffen, Alkoholen, Aldehyden oder
Ketonen ist problematisch, vor allem wenn es um die Isolierung von Zwischenstufen geht. Denn
die organischen Lösemittel lassen sich - nach Anzünden als Aktivierung - meistens nur nach dem
"Alles oder Nichts"-Prinzip oxidieren. Sie verbrennen deshalb meistens nur zu CO2
und H2O.
Mit heterogenen Katalysatoren kann man organische Stoffe gezielter umsetzen, oftmals sogar die Reaktionen in die gewünschten Richtungen lenken oder sie einfach nur "ausbremsen".
Mit Platin auf dem Weg zum Formaldehyd
Das erkennt man bei der spektakulären Oxidation von Methanoldampf in Anwesenheit von Platin.
Dabei entsteht Formaldehyd (-> Versuch).

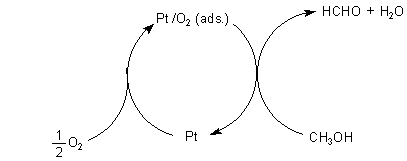
Am Platinmetall findet anders als beim Kupfer (-> Versuch) keine Primäroxidation des katalysierenden Schwermetalls zu seinem Oxid statt, sondern zunächst nur eine simultane Anlagerung der beiden Edukte Methanol und Sauerstoff. Denn Platin bildet mit Sauerstoff direkt keine Oxide.
Das blanke Platin ist mikrokristallin aufgebaut. Es liegen also zufallsbedingt viele verschieden orientierte Kristalle nebeneinander vor. Wie sich die Edukte anlagern, hängt vom kristallinen Aufbau des kubischen Platingitters ab. Bestimmte Flächen dieser Kristalle werden nur vom Sauerstoff, die anderen nur vom Methanol besetzt. Man sagt, dass die heterogene Katalyse anisotrop sei. Durch Überlappen der "Molekülorbitale" des Metalls (seine so genannten Leitungsbänder) und der Molekülorbitale der Edukte wird die Redox-Reaktion vorbereitet. Eingeleitet wird sie durch Kontakt der so aktivierten Edukt-Moleküle an den Grenzbereichen der Kristallflächen.
Wie beim Döbereiner Feuerzeug beginnt die Reaktion mit dem Aufglühen des Metallnetzes. Bei vollständiger Reaktion entzündet die gesamte Reaktionsmischung. Damit verschwindet die Glut des Metallnetzes. Denn nun fehlen für kurze Zeit die Edukte der Reaktion. Diese müssen erst langsam wieder in das Reaktionsgefäß einwandern, sich dann auf der Oberfläche ihre Plätze suchen und dann die Reaktion erneut einleiten. Damit wird wieder Reaktionswärme frei, die das Platinmetall zum Glühen bringt. Diese Glut zündet erneut das im Reaktionsgefäß gebildete Reaktionsgemisch aus Methanoldampf und Sauerstoff.
Insgesamt resultiert daraus eine bemerkenswert lang anhaltende, beeindruckende Oszillation, die allerdings etwas experimentelles Geschick und chemisches Fingerspitzengefühl erfordert.
 |
| (Foto: Daggi)
Hierzu gibt es einen Film (8,7 MB) Klicke hier |
Weitere Texte zum Thema „Aldehyde und Ketone“