
Die alkoholische Gärung als Naturphänomen

Die alkoholische Gärung als Naturphänomen
Experimente:
Versuch: Vergären von Traubenzucker
Die Bezeichnung Alkohol ist uns meist von alkoholischen Getränken bekannt. Wenn
man allgemein von Alkohol spricht, ist das in diesem Zusammenhang aber nicht ganz richtig.
Denn das, was wir als Alkohol bezeichnen, ist nur eine Verbindung aus der Gruppe der
Alkohole. Chemiker nennen diesen speziellen Alkohol Ethanol oder Ethylalkohol.
Chemisch gesehen ist er ein Oxidationsprodukt des Ethans
und hat die Summenformel
C2H5OH
Der natürliche Alkohol ist ein Produkt der Gärung
Der Alkohol wird den Spirituosen wie Wein oder Bier nicht einfach hinzugegeben, sondern
er entsteht durch eine natürliche chemische Reaktion. Das ist sogar gesetzlich geregelt.
Die Gewinnung von Alkohol ist ein sehr altes Verfahren, das von Generation zu Generation überliefert wurde. Schon seit Jahrtausenden ist die Zubereitung alkoholischer Getränke bekannt. Schließlich ist die alkoholische Gärung ein Naturphänomen, das nicht durch den Menschen erfunden wurde.
Vereinfacht gesagt ist die alkoholische Gärung der biologische Abbau von Glucose ohne Mitwirkung von Sauerstoff. Dabei wird (vor allem durch Hefepilze) der Zucker zu Ethanol und Kohlenstoffdioxid abgebaut. Die Ausgangsstoffe für die Alkoholsynthese sind überall zu finden: Glucose ist in allen Früchten enthalten und Hefepilze sind vielfach in der Luft verbreitet. Auch die Bedingungen des Luftabschlusses sind überall in der Natur gegeben. Deshalb findet die alkoholische Gärung an vielen Orten statt.
Die Biochemie der alkoholischen Gärung
Alle Organismen benötigen Energie zum Überleben. Das gilt auch für die Hefezellen.
Die universelle Energiewährung der Zellen ist ATP. ATP dient als
Energieüberträger und Energiespeicher. Normalerweise benötigt man zur Synthese von ATP Sauerstoff,
also "aerobe" Verhältnisse. Dies ist die schematische/formale Reaktionsgleichung der Atmung.
C6H12O6 + 6 O2 + 38 (ADP + Pi) ———> 6 CO2 + 6 H2O + 38 ATP
(Pi ist das Symbol für ein anorganisches (engl. inorganic) Phosphat-Ion.)
Hefezellen können aber auch ohne Sauerstoff überleben. Dazu bedienen sie sich eines besonderen Tricks:
Sie stellen ihren Stoffwechsel von Atmung auf Gärung um.
Da unter diesen "anaeroben" Bedingungen vergleichsweise nur sehr wenig Energie gewonnen wird, müssen
die Hefezellen besonders viel Glucose umsetzen. Und das Endprodukt sind auch nicht mehr Wasser und
Kohlenstoffdioxid, sondern Ethanol und Kohlenstoffdioxid. Das zeigt die formale Reaktionsgleichung der alkoholischen
Gärung.

Die alkoholische Gärung ist ein mehrstufiger Prozess
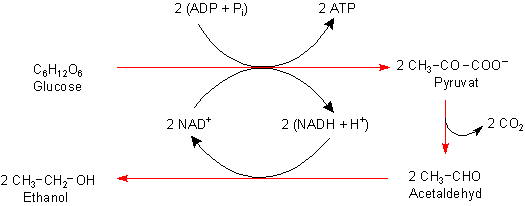
Schematischer Mechanismus der alkoholischen Gärung
Der erste Schritt ist die Glykolyse, in der Glucose unter
Mitwirkung von zahlreichen Enzymen zu zwei Molekülen Brenztraubensäure (Pyruvat) oxidiert wird.
Oxidationsmittel ist NAD+. Dieser Prozess ist exergonisch (Energie liefernd), und ein
Teil der gewonnenen Energie wird zur Phosphorylierung von zwei ADP zu ATP-Molekülen benutzt.
Das würde an sich für das Überleben der Hefezelle schon reichen. Aber der Zelle geht rasch das
Oxidationsmittel NAD+ aus.
Die nächsten Schritte dienen deshalb ausschließlich dazu, aus NADH wieder NAD+ herzustellen. Dazu wird zunächst Kohlenstoffdioxid aus der Brenztraubensäure abgespalten, so dass Acetaldehyd entsteht. Dieser wird anschließend enzymatisch mit NADH zu Ethanol reduziert, wodurch wieder NAD+ für die Glykolyse bereitgestellt wird.
Für die Hefe ist die Bilanz der alkoholischen Gärung
ernüchternd
Zuletzt hat die Hefezelle ihr Ziel erreicht, denn sie kann in dem Gärungsprozess ATP nun ohne Sauerstoff
bilden. Jedoch hat der Trick auch seinen Preis. Es zeigt sich ein großer Unterschied in der Energieausbeute
bei aerobem und anaerobem Glucose-Abbau. Aerob entstehen aus einem Mol Glucose etwa 38 Mol ATP, während es
anaerob nur zwei Mol sind.
1 Mol ATP entspricht der Energie von ca. 50 kJ. Somit erhält man unter aeroben Bedingungen beim biochemischen Abbau aus einem Mol Glucose eine Energie von 1900 kJ! Dagegen ist der Energiegewinn bei der Gärung mit 100 kJ wesentlich geringer.
Auf den Vergleich zwischen Atmung und Gärung gehen wir genauer auf einer besonderen Webseite ein.
Weitere Texte zum Thema „Alkohol“