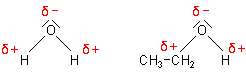
Alkohol löst nicht nur Probleme...
Experimente:
Versuch: Alkohol als Lösemittel
Versuch: Homologe Reihe und Löslichkeit der Alkohole
Allgemein gilt der Grundsatz "Gleiches löst sich in Gleichem". Somit lösen sich Stoffe in den
Lösungsmitteln, die in ihrem Aufbau und somit auch in ihrer Polarität ähnlich sind. Bei Alkohol ist
das anders.
Ethanol als Lösungsmittel
In Experimenten zeigt sich, dass Ethanol sowohl mit Wasser als auch mit Benzin mischbar ist
(-> Versuch). Das ist an sich sehr ungewöhnlich, denn Wasser und Benzin lösen
sich (fast!) überhaupt nicht miteinander. Also muss das Molekül von Ethanol etwas Besonderes an sich
haben, so dass es in der Lage ist, sich mit zwei so unterschiedlichen Stoffen vermischen zu können.
Um das Lösungsverhalten eines Stoffes gegenüber Wasser zu charakterisieren, benutzt man die beiden Begriffe "hydrophil" und "hydrophob".
Was bedeuten die Begriffe "hydrophil" und "hydrophob"?
Die Wörter kommen aus dem Griechischen. Hydro steht für Wasser, philos heißt
Freund und fobos bedeutet Furcht, Abneigung.
Das Gegenteil von hydrophil ist hydrophob, was so viel wie Wasser fürchtend
bedeutet. Man bezeichnet einen Stoff als hydrophob, wenn er schlecht oder gar nicht in Wasser löslich
ist. Das sind immer unpolare oder elektrisch neutrale Moleküle. Z. B. Fette, Öle und Alkane sind
hydrophobe Stoffe.
Ist ein Stoff fettlöslich, so bezeichnet man ihn auch als lipophil (griechisch lipos = Fett).
Die Erklärung für das Lösungsverhalten von Ethanol
Diese liefert uns sein molekularer Aufbau. Das Lösungsverhalten
dieser Verbindung wird also durch die unterschiedlichen Eigenschaften der beiden Molekülteile bestimmt.
Zum einen enthält sein Molekül eine Hydroxylgruppe (OH-Gruppe), die dem Wassermolekül
ähnlich ist. Die Fähigkeit, sich in Wasser zu lösen, verdankt das Ethanol dieser funktionellen Gruppe.
Deshalb bezeichnet man diesen Alkohol auch als einen hydrophilen (wasserliebenden) Stoff.
Doch woran liegt das? Die Bindung zwischen dem Wasserstoff- und Sauerstoffatom ist polar, weil das Sauerstoffatom die Bindungselektronen aufgrund seiner hohen Elektronegativität zu sich zieht und es nun eine höhere Elektronendichte hat. Somit gibt es eine positive Teilladung (δ+) am Wasserstoffatom und eine negative (δ-) am Sauerstoff. Ethanolmoleküle sind also Dipole - wie die Wassermoleküle. Beide Moleküle weisen die gleiche Polarität auf und sind deshalb ineinander löslich.
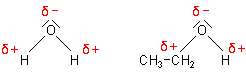
Polaritäten von Wasser und Ethanol
Obendrein können beide Verbindungen Wasserstoffbrücken untereinander ausbilden, wodurch Anziehungskräfte zwischen den Molekülen entstehen. Das ist ein weiterer Aspekt, der die Vermischung begünstigt. Ethanolmoleküle können jedoch nur eine Brücke zu ihrem Nachbarn ausbilden, Wassermoleküle hingegen zwei.
Zum anderen besitzt das Ethanol eine Alkylgruppe, einen benzinartigen Kohlenwasserstoffrest. Zwischen
diesem Rest und Benzin herrschen Van der Waals-Kräfte; das
sind Anziehungskräfte zwischen unpolaren Molekülen.
Die Kohlenwasserstoffe sind daher auch hydrophob (wasserabstoßend). Dank der Alkylgruppe
löst Ethanol auch unpolare Stoffe, wie z. B. Fette.
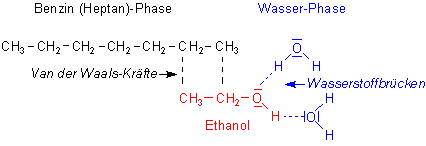
Ethanol löst sich in Benzin und Wasser
Ethanol kann in gewissem Umfang Wasser und Benzin "verbinden". Es bilden sich auf diese Weise sogar ternäre Gemische. Hierauf beruht auch eine Entwässerungsmethode für Alkohole.
Ethanol hat demnach sowohl einen hydrophilen als auch lipophilen Teil, was sein hervorragendes Lösungsverhalten erklärt.
Je länger die Ketten, desto hydrophober / lipophiler ist der
Alkohol
Nur die ersten drei Alkohole sind in Wasser in jedem Mischungsverhältnis löslich (-> Versuch).
Butanol zum Beispiel zeigt bereits schon eine Mischungslücke. Das erkennt man daran, dass sich beim Vermischen der beiden
Flüssigkeiten zwei Phasen bilden: Eine wasserreiche Phase (unten) und eine butanolreiche Phase (oben).
Besonders langkettige Alkohole (Fettsäure-Alkohole) verhalten sich vollständig wasserabweisend. Wenn
man sie jedoch in Benzin löst und auf Wasser gießt, dann bildet sich eine pelzartige Schicht von Alkoholmolekülen
auf der Wasseroberfläche - der Alkohol verhält sich wie ein Tensid. Die OH-Gruppe taucht ins
Wasser, die lipophile Kohlenwasserstoffkette zeigt in die unpolare Luft (-> Versuch).
Weitere Texte zum Thema „Alkohol“