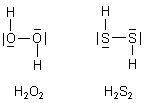
Gibt es auch ein Wasserstoffpersulfid?
Experimente:
Versuch: Erhitzen von Pyrit
Vom Wasserstoff gibt es bekanntlich auch ein Peroxid: Wasserstoffperoxid
H2O2. Das wirkt gegenüber Reduktionsmitteln als ein Oxidationsmittel,
gegenüber Oxidationsmitteln jedoch als ein Reduktionsmittel.
Wasserstoffperoxid ist eine schwache Säure. Ihre Salze entstehen aber nur, wenn man besonders unedle Metalle in Sauerstoff verbrennt.
2 Na + O2 ———> Na2O2 oder Ba + O2 ———> BaO2
Dies sind die Metallperoxide, z. B. Natriumperoxid oder Bariumperoxid. Im Kristallgitter
dieser Oxide liegen neben den Metall-Ionen tatsächlich O22--Ionen vor.
Wenn man Natrium- oder Bariumperoxid erhitzt, setzen sie Sauerstoff frei.
Mit Wasser bilden sie Wasserstoffperoxid. Das hat man früher auf diese Weise aus Bariumperoxid
gewonnen:
BaO2 + 2 H2O ———> Ba(OH)2 + H2O2
Man sollte nach den Regeln des PSE erwarten, dass es so etwas auch vom Schwefel gibt. Zunächst sind Metalldisulfide in der Natur bekannt. Das sind zum Beispiel der bekannte Pyrit und seine Modifikation Markasit: FeS2. Sie enthalten im Kristallgitter neben den Fe2+-Ionen S22--Ionen. Wenn man diese Mineralien erhitzt, setzen sie Schwefel frei (-> Versuch).
Wie sieht es aber mit dem Wasserstoffpersulfid H2S2 aus? Anders als die Metallperoxide reagieren die Metalldisulfide nicht mit Wasser. Das H2S2 gibt es dennoch. Es ist aber sehr schwer aus Polysulfiden und Salzsäure herzustellen und deshalb eine eher exotische Substanz.
Der Winkel, den die drei Atome O-O-H einschließen, beträgt beim Wasserstoffperoxid nur 94,8 °.
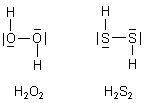
Daraus schließen wir, dass die Hybridisierung geringer ausfällt als beim Wassermolekül. Grund ist wohl, dass die Konstellation O-O (verglichen mit H-O) einen stärkeren Zug auf die 2s- und 2p-Elektronen ausübt. Das ist auch schon an der stärkeren Acidität von H2O2 zu erkennen. Eine Hybridisierung würde keinen sonderlichen Energiegewinn bringen. (Siehe hierzu die Webseite "Wir vergleichen die Moleküle von Schwefelwasserstoff und von Wasser".)
Anders als H2O2 ist H2S2 nur ein Reduktionsmittel.
H2S2 ———> 2 S + 2 H+ + 2 e-
Es zerfällt außerdem rasch in H2S und Schwefel (Disproportionierung).
Weitere Texte zum Thema „Schwefel“