Prof. Blumes Tipp des Monats Februar 2002 (Tipp-Nr. 56)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Der Kunststoffbrand in Brake.
Warum man zu Hause stets pH-Papier haben sollte
 |
| Bild 1 (Foto: Blume) |
Den Silvestertag von 2001 nach 2002 werden wir als Nachbarn des Bielefelder Stadtteils Brake auch
langfristig wohl kaum vergessen: Da brannte nämlich einige Hundert Meter weg von
uns ein Kunststofflager ab. Abgesehen von der großen Lagerhalle und dem anderen
Kram verbrannten dort 200 t PVC-Granulat und 800 t andere Kunststoffe.
Gegen 14 Uhr fing es an zu brennen. Gelöscht war der Brand wegen der Brandnester
in der Kunststoffschmelze erst Tage später. Über uns zog eine mächtige Qualmwolke
hinweg. Gequalmt hat es bis zum Neujahrsmorgen!
Das Bemerkenswerteste war, dass die Wolke, die stundenlang über uns hinwegzog, nicht nur fette Rußpartikel, ausgeglühte Dachstücke und feine Asche ausschüttete: Aus ihr regnete und schneite es! Denn es war sehr kalt und der Wasserdampf kondensierte. Die Schneeflocken und die Regentropfen brannten auf der Haut. Unser Nachbar hatte sogar eine Schneeflocke ins Auge bekommen und war mächtig am Fluchen und Augenreiben...
Wir hatten das Radio eingeschaltet. Ein bis zwei Stunden lang kamen keine Hinweise auf Umweltschäden. Der Lokalsender Radio Bielefeld dudelte wie üblich immer noch Popmusik.
Zeit also, das einfachste Nachweismittel für sich anbahnende Katastrophen zur
Hand zu nehmen: Das pH-Papier.
Das haben wir getan. Es wurde nicht nur rot, sondern tiefrot, sozusagen ultrarot.
Das folgende Bild zeigt das von wenigen Regentropfen gerötete pH-Papier sowie die Rußkörner
auf dem Schnee auf unserer Terrasse.
 |
| Bild 2 (Foto: Blume) |
Untersuchen wir einmal das Brennverhalten von Polyvinylchlorid - also von PVC - im
Labor.
|
Versuch 1: Verbrennen von PVC und pH-Messung im Rauch
|
 |
| Bild 3 (Foto: Daggi) |
Wenn man den Versuch durchführt, stellt man fest, dass sich das PVC kaum
entzünden lässt. Wie können dann die 200 t abbrennen? Klar: Die anderen Kunststoffe
haben als Brennfackel geholfen, so wie bei unserem Versuch das Gas aus dem
Bunsenbrenner.
Zurück zum Versuchsergebnis: Beim Verbrennen entsteht sehr viel Ruß. Das pH-Papier wird
tiefrot, ja fast lilarot.
Halten wir fest: Beim Verbrennen von PVC entstehen große Mengen an Ruß und viel
starke Säure. Welche Säure das ist, zeigt der folgende Versuch.
 |
| Bild 4: Apparatur zum Verbrennen von PVC
(Foto: Daggi) |
|
Versuch 2: Identifizierung der Säure, die beim Verbrennen von PVC entsteht
|
Es bildet sich weißes Silberchlorid. Bei der Säure handelt es sich also um Salzsäure.
Während es kräftig brannte und die Rauchwolke schon über der ganzen Stadt zu sehen war, hörte man auch in den ersten Nachrichten um 15 Uhr noch nichts zu dem Brand. Und das, obwohl die Leitenden wussten, dass PVC brennt. Erst viel später wurde in den Nachrichten sogar noch gesagt, dass die Messungen der Feuerwehr nichts Nachteiliges ergeben hätten. Da hat es bei uns schon den eben beschriebenen sauren Regen und Schnee gegeben, und Rußkörner fielen in großen Mengen vom Himmel! Erst gegen Abend wurde dann vorsichtig vorgeschlagen, Türen und Fenster geschlossen zu halten. Und erst am 3. Januar stand auch in der NW, der dominierenden Lokalpresse, dass die Niederschläge vielleicht Dioxin enthalten könnten.
Deutlich gesprochen: Selbst ein chemisch nicht allzu gebildeter Mensch - also auch ein Rundfunk- oder Zeitungsredakteur - sollte endlich langsam hellhörig werden, wenn er erfährt, dass große Mengen an PVC verbrennen. Dass dabei schädliche Stoffe entstehen, versteht sich von selbst und müsste sich so langsam mal herumgesprochen haben. Denn PVC besteht zu 56,8 % aus Chlor. Das kann man anhand der Atommassen leicht berechnen. Hier ist die schematische Formel des Kunststoffs.
-[-CH2-CHCl-]-n
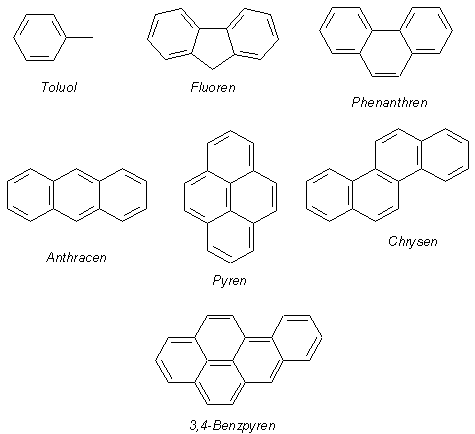
Alle Fachleute wissen: Wenn die Bedingungen günstig sind (und das sind sie fast immer), gibt es bei PVC-Bränden auch Ultragifte wie die Dibenzodioxine und Dibenzofurane (kurz: Dioxine). Zu diskutieren ist nur deren Konzentration. Ganz abgesehen vom Ruß und von den daran fixierten hochgiftigen, teilweise sogar cancerogenen polykondensierten Aromaten wie Benz(a)-Pyren, Pyren und Chrysen.
Dass die nun auch in unserem Vorgarten herumliegen, können wir mit einem chromatographischen Hochleistungsverfahren, der HPLC, nachweisen. Das haben für uns Studierende der Umweltwissenschaften (GSU), die jetzt in unserem Labor gerade ihr chemisches Praktikum ableisten, getan.
|
Versuch 3: Nachweis von polykondensierten Aromaten in Erdproben aus unserem Vorgarten Als Probe nehmen wir den rußigen Schnee und etwas Boden. Den trocknen wir mit wasserfreiem Natriumsulfat, extrahieren die Mischung im Ultraschallbad mit Cyclohexan und filtrieren ab. Man dampft zur Trockne ein und nimmt mit Acetonitril auf. Die Lösung wird in die HPLC-Anlage injiziert. (Die genaue Vorschrift findet man auf einer gesonderten Webseite.) |
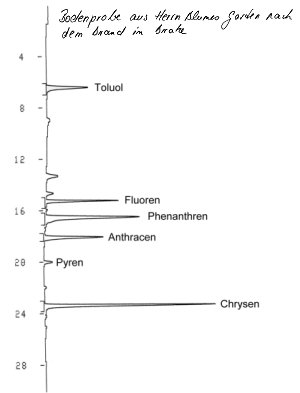 |
| Bild 5: HPLC-Chromatogramm einiger PAK aus der Bodenprobe aus Blumes Vorgarten |
Das Chromatogramm oben zeigt das Ergebnis. Wir haben mindestens sechs
hochkonzentrierte, teilweise giftige Substanzen identifiziert, nämlich Toluol,
Fluoren, Phenanthren, Anthracen, Pyren und Chrysen. Mit
Benz(a)-Pyren arbeiten wir aus Prinzip nicht, können es deswegen auch nicht
nachweisen.
Also wäre es vonseiten der Feuerwehr und von den Medien nett gewesen, wenn sie sofort nach Brandausbruch und Kenntnisnahme, dass hier große Mengen an PVC brennen, prophylaktisch die Leute viel früher vor möglichen Umweltschäden gewarnt hätten. Dabei sollten mögliche Abwägungen wegen der Schadensersatzansprüche keine Rolle spielen. Denn da haben zum Beispiel noch viele Kinder im Garten gespielt. Es war schließlich ein sonniger Schneetag. Hinzu kamen die vielen Zuschauer, die möglichst nahe an den Brandherd gelangen wollten und dort entsprechend lange ausharrten. Und es betraf auch die Feuerwehrleute, die den Brand bekämpften, sowie die Polizisten, die tapfer Wache standen.
Wenn man sich also nicht auf die städtischen Umwelt-Beamten, Feuerwehr-Sprecher und Medien verlassen will, sollte man wenigstens eine Rolle pH-Papier zur Hand haben. Wenn das eine saure Reaktion anzeigt, ist Gefahr im Verzug!
Nehmen Sie aber nicht Lackmuspapier, sondern das gute Universalindikator-Papier. Wichtig ist, dass man das Papier gut und luftdicht verpackt aufbewahrt (zum Beispiel in einem verschlossenen Marmeladenglas). Wenn man mit einem Brand konfrontiert wird, kann man das Gefahrenpotential selbst abchecken.
Das Universalindikator-Papier hätten übrigens auch die Leute gut gebrauchen können, die am 21.12.01 der Stickoxid-Attacke am Rhein ausgesetzt waren.
Bei Sonnenuntergang hat es am Silvesterabend in Brake übrigens immer noch gebrannt.
Das rote Licht der untergehenden Sonne färbte die Brandwolken prächtig braunrot. Das waren
also glücklicherweise keine Stickoxidwolken wie am Rhein!
 |
| Bild 6 (Foto: Blume) |
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 03. Januar 2012, Dagmar Wiechoczek