Prof. Blumes Tipp des Monats November 1999 (Tipp-Nr. 29)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
 |
| Bild 1 (Foto: Daggi) |
Was ist eigentlich Lackmus?
Vor einigen Tagen schickte mir Martin Zimmer vom Planet Interkom.de folgende E-Mail:
Ich suche schon seit Monaten verzweifelt nach der Strukturformel des Indikatorfarbstoffs in
Lackmus. Wurde diese an der Uni Bielefeld schon einmal gesehen? Wenn ja, würde ich mich
über selbige freuen.
Beim Lackmus handelt es sich bekanntlich um eine Allerwelts-Chemikalie. Jeder Schüler hat sicherlich mit ihr schon einmal Kontakt gehabt. Aus dem Chemieunterricht ist Lackmus vor allem als Indikatorfarbstoff mit dem weiten Umschlagsbereich 5-8 vertraut.
|
Versuch 1: Lackmus als Indikator
|
Lackmus verwendete man übrigens nicht nur als Indikator. Dass man mit Lackmus aber seit etwa 1300 in Florenz und in den Niederlanden Kleiderstoffe färbte, soll nicht unerwähnt bleiben. Auch als Färbemittel für Lebensmittel, Liköre und Medikamente ist Lackmus bekannt. Er wurde sogar als den "Gilb" überstrahlendes Wäscheblau verwendet. Heute wird er aber nur noch als Indikator benutzt.
Wie sieht die Struktur von Lackmus aus? [2,3]
Bei dem Lackmusfarbstoff handelt es sich genau genommen um eine Gruppe von etwa 14 Stoffen mit
einer Molmasse bis zu 3000 g/mol, die sehr kompliziert zusammengesetzt
sind. Andererseits zeigen sie eine bemerkenswerte Regelmäßigkeit im Aufbau. Diese
Farbstoffe konnten erst 1961 strukturell aufgeklärt werden! [1]
Ihr molekulares Zentrum gehört zur Klasse der Oxazine.
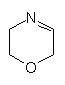
Oxazin
An dieses Oxazin sind formal zwei Moleküle des für Flechten typischen Diphenols Orcin gebunden.
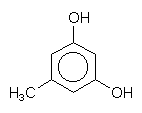
Orcin
Das Zentrum des Farbstoffmoleküls sieht dann so aus:
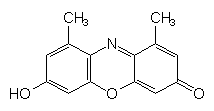
Orcein
Dieses Molekül heißt Orcein. Die farbtragende Gruppe ist also ein substituiertes 7-Hydroxy-phenazin-2-on. Denkt man sich das O-Atom im Oxazinring weg, hat man ein Farbstoffmolekül vom Typ der Indophenole wie beim DCPIP, dem Nachweisreagenz auf Ascorbinsäure.
Im Lackmusfarbstoff sind 3 bis 5 Reste dieses Orceins über jeweils zwei weitere Orcinmoleküle verbrückt:
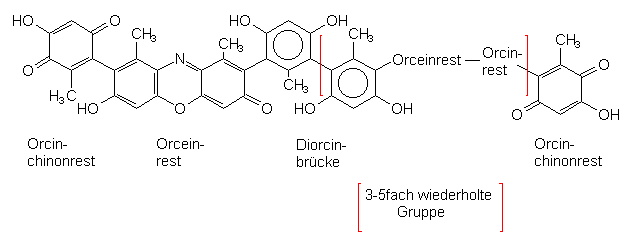
Ein typischer Lackmusfarbstoff
Anfang und Ende der Kette werden durch Chinone gebildet, die ebenfalls auf das Orcin zurückzuführen sind.
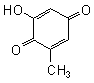
Ein typisches Orcinchinon
Insgesamt ergibt sich eine lange Kette von ungesättigten Verbindungen. Deren Wechselwirkung untereinander ist für die Farbigkeit verantwortlich. Diese Mesomerie wird noch durch die Starrheit der Kette gefördert. Denn die Bausteine behindern sich aufgrund ihrer Substituenten derartig, dass Drehungen um die Bindungen zwischen den aromatischen Kernen nicht mehr möglich sind.
Letztlich sind alle Teile des polymeren Lackmusfarbstoffs auf Orcin zurückzuführen. Denn auch das Orcein kann man aus Orcin herstellen, indem man dieses Diphenol mit Ammoniak und Wasserstoffperoxid behandelt. (Der Name Orcin kommt von Orseille-Farbstoff, der wie Lackmus typisch für Flechten ist; siehe unten.)
Zur Indikatorwirkung von Lackmus
Die Farbveränderung bei der Zugabe oder Wegnahme von Protonen
(Halochromie) beruht auf der reversiblen Bildung von Phenolen (rot)
aus Phenolaten (blau) sowie aus der Protonierung des Oxazinsystems.
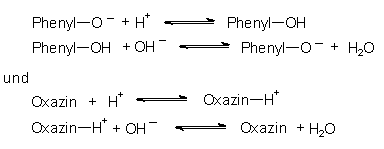
Außerdem ändert sich zusätzlich auch noch die Tönung der für Lackmus charakteristischen Farben Rot und Blau, wenn man starke oder schwache Säuren bzw. Basen zum Lackmus gibt. Das resultiert aus der schrittweisen Anlagerung bzw. Entfernung weiterer Protonen.
Lackmus ist auch ein Redoxfarbstoff
Der Oxazinring erinnert stark an den Thiazinring, wie er z. B. im Methylenblau
auftritt. Diesen Farbstoff kennst du vielleicht vom Überraschungsversuch
"Blaues Wunder"
oder aus der Biochemie. Methylenblau ist ein Redoxfarbstoff, der im oxidierten Zustand blau, im
reduzierten farblos ist (Leukofarbstoff). Die gleichen Eigenschaften sollte man deshalb
auch beim Lackmus erwarten. Reduktionsmittel ist Schwefelwasserstoff.
|
Versuch 2: Redoxverhalten von Lackmus
|
Folgende Veränderungen sind im Orcein-Molekülrest bei der Redoxreaktion zu erwarten:
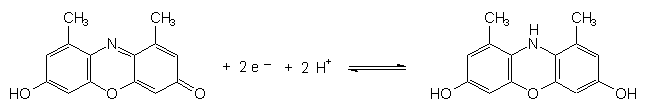
Reversible Redoxreaktion des Orceins
Die Elektronen stammen aus dem Reduktionsmittel:
H2S ———> 2 H+ + 2 e- + S
Woher kommt Lackmus eigentlich?
Lackmus und der verwandte Orseille-Farbstoff werden aus tropischen
Flechten (Orseille-Flechten) gewonnen. In Küstenregionen ist z. B. die Rocella tinctoria
(Name!) angesiedelt, in Gebirgsregionen findet man Lecanora subfusca sowie
Ochrolechia tartarea (Kuchenflechte).
Lackmus ist allerdings kein direkter Flechtenfarbstoff, sondern wird erst durch
künstliche und teilweise recht aufwendige Behandlung aus Flechteninhaltsstoffen hergestellt [5].
Dazu wird die gemahlene Flechte in einer wässrigen Lösung von Ammoniumcarbonat,
Kaliumcarbonat und Kalkstein verrührt und unter gelegentlichem Zusatz von Ammoniak
mehrere Wochen sich selbst überlassen, bis die Farbe der Lösung rein blau geworden ist
("Gärung").
Dieser Rohlackmus ist allerdings ein Gemisch aus einer Vielzahl von roten, violetten und
farblosen Substanzen. Durch weitere Behandlung kann man diese Stoffe weiter auftrennen. Dabei gelangt
man z. B. zum Azolitmin, einem lackmusähnlichen Farbstoff, der ebenfalls als Indikator
genutzt wird.
 |
| Bild 2: Eine Lackmusprobe der Firma Fluka
(Foto: Daggi) |
Rüdiger Blume
Literatur:
| [1] | H. Musso et al.: Angew. Chemie 73, 665 (1961). |
| [2] | F. Klages: Lehrbuch der Organischen Chemie, Band III, Walter de Gruyter & Co, Berlin 1967. |
| [3] | W. Kratzert, R. Peichert: Farbstoffe, Quelle & Meyer, Heidelberg 1981. |
| [4] | G. Natho et al.: Rohstoffpflanzen der Erde, Verlag Harri Deutsch, Thun und Frankfurt/Main 1986. |
| [5] | Ullmanns Enzyklopädie der technischen Chemie, Band 7, München und Berlin 1956. |
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 12. November 2009, Dagmar Wiechoczek