Prof. Blumes Tipp des Monats Februar 2005 (Tipp-Nr. 92)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.

Bild 1 (Foto: Blume)
Der Aschensammler
Es ist Winter, und viele Leute erfreuen sich an der Wärme, die ein Ofen oder ein Kamin abgibt. Wohin aber mit der Asche? Heute wandert diese in den Mülleimer ("Keine heiße Asche einfüllen!"). Früher war das ganz anders.
In meiner Jugendzeit wurde bei uns nur mit Öfen und Kamin geheizt. In dem alten Patrizierhaus existierte keine Zentralheizung. Entsprechend viel Asche fiel an. Hinter unserem Wohnhaus gab es ein großes Lagerhaus. In dem befand sich eine große, ca. 4 mal 4 Meter messende gemauerte Einfassung, die Aschenecke. Ein jeder aus unserem Hause brachte die Asche seines Ofens dort hin - obwohl keiner so recht wusste, warum. In der Asche tummelten sich nur noch die Hühner, die aus dem Garten kamen, um darin ihre Staubbäder zu nehmen - wohl nur aus diesem Grunde wurde noch weiter gesammelt. Dabei steckt hinter dem Aschesammeln handfeste Wirtschaftsgeschichte.
Hört man heute das Wort "Aschensammler", so denkt man an den Aschenbecher auf dem Schreibtisch oder an Abluftfilter in einem Heizkraftwerk. Früher war das ganz anders: Damals gab es den Beruf des Aschensammlers. Diese Leute zogen von Haus zu Haus und sammelten die Ofen-, Kamin- und Herd-Aschen ein. Aschensammler waren meistens die Ärmsten unter den Armen. Und dabei waren die Inhaltsstoffe der Asche schon damals so wichtig und auch kostbar! Asche war nämlich ein wichtiger Rohstoff. Heute würde man die Asche als Nachwachsenden Rohstoff bezeichnen.

Bild 2: Holzkohlenasche im Grill
(Foto: Blume)
Um zu verstehen, wozu man die Asche sammelte, müssen wir zunächst wissen,
welche Eigenschaften Holzasche hat.
|
Versuch 1: Holzasche in Wasser
|
Zunächst stellen wir fest, dass nicht alle Aschensubstanz in Wasser löslich ist. Außerdem reagiert die Aufschlämmung deutlich alkalisch. Wir haben einen pH-Wert von 11,58 gemessen. Hier wird deutlich, warum Holzasche direkt zum Waschen benutzt wurde. Da war einmal der mechanische Effekt der nicht löslichen Holzaschensubstanzen. Dazu kam das alkalische Milieu, das zum Quellen der Fasern und zum Herauslösen sowie zum Zersetzen der Fette nützlich war.
|
Versuch 2: Wie ist Holzasche zusammengesetzt?
|
Aufmerksame Beobachter von Ofenfeuern hätten das Ergebnis auch schon voraussagen können. Dazu muss man nämlich die Farben von Flamme und Aschenglut genauer betrachten. Dann fällt auf, dass die Flamme aufgrund des Leuchtens von freiem Kohlenstoff zwar gelb ist, die Asche aber deutlich purpurn („fahlviolett“) glüht.
Klick mich an!
Bild 5: Ofenflamme
(Foto: Blume)
Anschließend untersuchen wir die Eigenschaften von reinem Kaliumcarbonat aus der Sammlung.
|
Versuch 3: Untersuchung von Kaliumcarbonat (Pottasche)
Ergebnis:
|
Wir schließen daraus: In der Holzasche ist Kaliumcarbonat enthalten.
Kalium ist typischer Bestandteil vor allem von Landpflanzen. Dagegen enthalten Meerespflanzen oder Pflanzen, die am Meeresstrand wachsen, mehr Natrium, deshalb enthält ihre Asche mehr Soda (Natriumcarbonat Na2CO3). Es gibt sogar Pflanzen, die ihr überschüssiges Natrium als Soda "ausschwitzen". Deren Blätter sind mit feinen, glitzernden Kristallen überzogen. Bekannt ist wohl den meisten Urlaubern auf den Kanarischen Inseln oder in der Algarve die rotblühende, buschige Barilla. Im Deutschen heißt sie Sodapflanze (Mesembryanthemum crystallinum). Mit der wurde schwunghafter Handel getrieben.

Bild 6: Sodapflanze auf Fuerteventura
(Foto: Blume)
Jetzt ist es an der Zeit, auf die Frage eines Gymnasiasten
zu antworten:
F: Die Verbrennung von Landpflanzen liefert Pottasche. Ist es möglich, eine
(einleuchtende) Erklärung für die Entstehung der Carbonat-Ionen zu geben? Wir behelfen uns mit mehr
oder weniger realistischen Annahmen und kommen nicht wirklich zu einem vernünftigen Ansatz.
Wir hoffen, dass Sie uns auf eine Spur bringen können...
A: Ist Ihnen klar, dass Biomasse vor allem aus Kohlenstoffverbindungen besteht? Wenn Sie die verbrennen, bildet sich CO2, und in Gegenwart von Metall-Ionen bilden sich zusammen mit den Oxiden der in den Pflanzen enthaltenen Metalle auch Metallcarbonate.
K2O + CO2 ———> K2CO3
Wie man früher Pottasche herstellte
Kaliumcarbonat nannte man Pottasche. Über den Ursprung des Namens
ist man unterschiedlicher Ansicht. Die einen meinen, dass er daher rührt, dass man die Substanz
in einem Topf (Pott) auslaugte. Andere meinen, dass die Asche früher aus der Feuerstelle in einen
runden Pott fiel.
Ist alles letztlich egal. Man laugte die Holzasche durch Kochen mit Wasser aus.
Zurück blieben schwer lösliche Substanzen wie Calcium- und Magnesiumcarbonat.
Nach dem Abfiltrieren erhielt man eine Lösung, die eingedampft wurde und die
man anschließend noch glühte.
|
Versuch 4: Herstellen von Pottasche aus Holzasche
|
Werden beim Glühen nicht alle Carbonate zerstört? Nein: Natrium- und Kaliumcarbonat sind (in Grenzen) hitzestabil.
|
Versuch 5: Untersuchung von Pottasche/Kaliumcarbonat aus Holzkohle
|
Nun lernen wir noch einen weiteren, diesmal chemischen Nachweis von Kalium-Ionen kennen. Mit Perchlorat-Ionen bilden sie einen schwerlöslichen Niederschlag. Der Nachweis ist nicht besonders empfindlich und erfordert deshalb höhere Konzentrationen, ist aber ansonsten typisch.
|
Versuch 6: Chemischer Nachweis von Kalium-Ionen mit Perchlorat
Das Gleiche wiederholen wir mit einer klaren Lösung, die wir durch Zutropfen von wenig
Salzsäure zum eingetrockneten Rückstand des Filtrats der Holzasche-Extraktion erhalten.
|
Wofür man Pottasche benötigte
1 Pottasche entwickelt mit Wasser ein
alkalisches Milieu. Das liegt daran, dass Carbonat-Ionen mit Wasser reagieren.
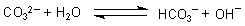
Das unterstützt den Waschvorgang. Aus diesem Grunde setzte man in frühen Zeiten, als es noch keine billige Seife gab, Holzasche direkt zum Waschen ein.
2 Die Carbonat-Ionen der Pottasche fällen zugleich die Härtebildner (Calcium- und Magnesium-Ionen) aus. Pottasche ist also ein Wasserenthärter.
Ca2+ + CO32- ———> CaCO3
3 Mit Pottasche kann man Seife herstellen ("sieden"). Dazu kochte man Abfallfette mit der alkalischen Lösung.
|
Versuch 7: Herstellung von Seife
|
Oftmals waren die Aschensammler selbst Seifensieder. Man hört in diesem Zusammenhang, dass die Aschensammler den Haushalten als Lohn für eine große Menge Asche ein Stück Seife gaben. (Siehe zum Beispiel bei Bechsteins Märchen.) Genau genommen macht man mit Hilfe von Pottasche Schmierseife; deshalb wird es wohl ein Topf voll Schmierseife gewesen sein, der als Lohn winkte. (Feste, also Kernseife, erhält man nur mit Soda.)
4 Kaliumcarbonat ist auch heute noch ein Rohstoff für die Glasherstellung. Allerdings sind diese Kaligläser nicht sehr stabil gegen Umwelteinflüsse. Leider hat man aus ihnen ganz besonders gern die bunten Kirchenfenster gemacht. Die zerfallen deshalb ganz besonders schnell.
Welche Bedeutung die Pottasche für die Glasherstellung hatte, belegt eindrucksvoll die folgende, von O. Krätz übermittelte Story: Zur Verglasung der Orangerie Friedrichs des Großen in Potsdam benötigte man Pottasche, die aus 50 ha Buchenwald gewonnen wurde.
5 Man stellte mit Hilfe Pottasche auch Kalilauge her. Hierbei ließ man die Lösung mit gelöschtem Kalk oder mit Kalkwasser reagieren. Das Verfahren hieß Kaustifizierung. Da man das besonders mit Soda machte, zeigen wir das an diesem Beispiel. Sie werden das natürlich mit Pottasche wiederholen.
|
Versuch 8: Kaustifizierung von Soda
|
Das ist doch merkwürdig: Da geben wir zwei Lösungen mit niedrigerem pH-Wert zusammen; nach dem Mischen steigt
der pH-Wert an. Dahinter steckt folgende chemische Reaktionsfolge:
Aus dem Calciumoxid bildet sich zunächst Calciumhydroxid.
CaO + H2O ———> Ca(OH)2
Diese in Wasser schwerlösliche Verbindung dissoziiert in geringem Umfang. Dieser Vorgang ist ein chemisches Gleichgewicht.
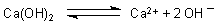
Die Calcium-Ionen reagieren mit den Carbonat-Ionen der leicht löslichen Sodalösung zu schwerlöslichem Calciumcarbonat.
Ca2+ + CO32- ———> CaCO3
Zurück bleiben die Natrium- und die Hydroxid-Ionen. Da sich die Carbonat-Ionen der Soda im Überschuss
befinden, bildet sich das schwerlösliche Calciumhydroxid langsam in Calciumcarbonat um - unter Freisetzung
von immer mehr OH--Ionen. Das hat zur Folge, dass der pH-Wert ansteigt.
Die folgende Gleichung beschreibt die Gesamtreaktion:
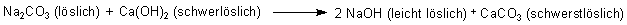
Auf diese Weise löst sich der Niederschlag von Calciumhydroxid nach und nach auf; stattdessen entstehen Kalk und Natronlauge!
Das Vorteil des Verfahrens liegt auf der Hand: Zwar ist auch gelöschter Kalk (oder Kalkwasser) eine Lauge; da Ca(OH)2 aber schwerlöslich ist, ist die Lauge hinsichtlich ihrer Konzentration relativ schwach. Dagegen ist die so gewonnene Natronlauge viel konzentrierter und deshalb wirksamer.
Was befindet sich sonst noch in der Holzkohlenasche?
Natürlich findet man auch Spuren von Phosphat, Sulfat und Nitrat. Hinzu kommen auch im Schullabor nachweisbare Mengen
an Chlorid. Denn Pflanzen verfügen hinsichtlich der Wassermengen, die sie ständig aufnehmen, über kein besonders effektives
Chlorid-Ausschlusssystem. Chlorid ist zugleich wichtig für die Pflanzen: Es spielt eine Rolle bei der Fotosynthese. Es ist
auch Cofaktor bei einigen Enzymreaktionen, vor allem aber bei Membranprozessen bzw. Ionenpumpen (insbesondere beim für
Pflanzen wichtigen, zellulären Kaliumaustausch). Aus diesem Grunde ist im Brennholz immer Chlorid enthalten. Die Konzentration
liegt allerdings im Promille-Bereich (in der Asche natürlich viel höher). Der Chloridgehalt reicht aber aus, um beim Verbrennen
von Holz Dioxine zu emittieren.
Last but not least
Von dem Namen Pottasche und Soda stammen die englischen
Bezeichnungen für die darin enthaltenen Alkalimetalle. Das englische sodium für Natrium ist
der Bezeichnung "Soda" entlehnt; potassium ist im Englischen das Kalium. Und ob das russische
Wort "Podsol" für ascheartige Heideböden etwas mit Pottasche zu tun hat - darüber streiten die Gelehrten.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 04. Dezember 2011, Dagmar Wiechoczek


