Prof. Blumes Tipp des Monats März 2001 (Tipp-Nr. 45)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Wir untersuchen Lakritz
Wohl jeder liebt die dunkelbraune, klebrige Lakritz und deren Geschmack. Der stammt
vor allem vom Süßholz (Glycyrrhiza sp.) und seinem Inhaltsstoff, dem typischen
Lakritzgeschmacksstoff Glycyrrhizin.
Als Säuerungsmittel ist auf der Zutatenliste, die auf den meisten Packungen zu finden ist,
oftmals "Ammonium chloratum" vermerkt. Das ist Apothekerlatein und bedeutet
Ammoniumchlorid. (Für den Chemiker ist
Ammoniumchlorat eine gefährliche, weil brandfördernde Substanz mit der Formel
NH4ClO3.) Weil Ammoniumchlorid auch
Salmiaksalz heißt, gibt es in Apotheken die
Salmiakpastillen, in denen besonders viel Ammoniumchlorid vorkommt.
Ammoniumchlorid darf nach der Aroma-Verordnung bis zu 20 g/kg oder 2 % in Lakritz
enthalten sein.
(Der Name Salmiaksalz kommt vom lat. sal ammoniacum, Salz des Ammon. Das war
die alte Bezeichnung für Ammoniumchlorid. Das wurde neben einem Jupitertempel
gefunden. Der hieß auch zu römischen Zeiten Jupiter Ammon. Das Ammon kommt
wieder vom ägyptischen Obergott Amun. Später verkürzte man die Bezeichnung sal
ammoniacum zu Salmiaksalz. Danach wurde 1782 durch T. O. Bergmann das
zugrundeliegende Ammoniak benannt.)
Ammoniumchlorid aus der Schulsammlung darfst du leider nicht probieren. Wenn dein Lehrer oder deine Lehrerin auf Zack sind, haben sie aber immer eine Flasche von sauberem Ammoniumchlorid zum Probieren beiseite gestellt. Auf jeden Fall kannst du sicher sein: Es schmeckt fein salzig-säuerlich wie Lakritz! (Der Geschmack des Salzes wird übrigens durch Glycyrrhizin verstärkt. Es sind also Geschmacks-Synergisten.) Dass es sauer wirkt, kannst du jedoch leicht mit pH-Papier nachweisen.
|
Versuch 1
|
Der Grund für den sauren Charakter ist, dass Ammoniumchlorid das Salz einer schwachen Base (NH3) und einer starken Säure (HCl) ist. Deshalb reagiert es mit Wasser unter Bildung von Protonen bzw. Oxonium-Ionen. Man kann auch sagen: Das Ammonium-Ion wirkt als Brönstedsäure und überträgt das Proton auf die Base Wasser.
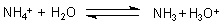
Der Gehalt an Ammonium-Ionen lässt sich auch durch Austreiben des Ammoniaks mit einer starken Base wie Natriumhydroxid zeigen.
NH4Cl + NaOH ———> NH3 + NaCl + H2O
|
Versuch 2 (Schutzbrille)
|
Mit Ammoniumchlorid kann man interessante Versuche machen. Es entsteht, indem man die Gase Ammoniak und Chlorwasserstoff zusammenleitet. Dies ist ein klassisches Beispiel für eine Brönsted-Säure/Base-Reaktion ohne Beteiligung von Wasser.
NH3 + HCl ———> NH4Cl /Exotherm
|
Versuch 3 (Schutzbrille)
|
Diese Substanz kann man leicht "abrauchen". So entfernte man sie bei der chemischen Analyse aus den zu untersuchenden Mischungen. Man sagt gern, dass Ammoniumchlorid sublimiert. So sieht das tatsächlich aus.
|
Versuch 4
|
Du siehst, dass sich das Papier blau färbt! Wenn es ein Sublimat von NH4Cl wäre, müsste es sich rötlich färben wie bei Versuch 1! Es muss also etwas anderes passiert sein. Das stimmt: Ammoniumchlorid zersetzt sich in der Hitze unter Rückbildung von seinen gasförmigen Bestandteilen.
NH4Cl + Energie ———> NH3 + HCl
Das kann man auch in einem anderen Versuch noch besser zeigen.
|
Versuch 5
Nun erhitzt du das Glas an der Spitze mit der kleinstmöglichen Flamme des Bunsenbrenners (siehe Bild links). Halte das Glas dabei senkrecht. Beobachte, wie sich das Indikatorpapier verfärbt. Das kannst du am besten von außen sehen. Achtung: Vermeide, dass es ankokelt! Es bilden sich rote und blaue Farbzonen aus (siehe Bild rechts). |
 |
 |
Hier kocht der Chef wieder einmal persönlich! (Fotos: Daggi)
Dass man verschiedene Farbzonen sieht, liegt daran, dass die beiden Gase Ammoniak und Chlorwasserstoff unterschiedlich dicht sind. Außerdem erhitzt man nicht gleichmäßig genug. Auf jeden Fall wird das Papier zunächst immer blau gefärbt, weil Ammoniak leichter ist als HCl-Gas. Die Farbzonen wandern abwechselnd nach oben.
Was ist Süßholz?
Süßholz (Glycyrrhiza glabra) ist eine mehrjährige Staudenpflanze, die 1 bis 1,5 m hoch wird.
Sie kommt im Mittelmeerraum und ähnlichen Klimazonen vor und wird sogar in Plantagen kultiviert.
Als Droge dienen ihre Wurzeln und Ausläufer, die man trocknet und zu Lakritz-Pulver verarbeitet.
Der Name Süßholz kommt daher, weil sein Inhaltsstoff, das Glycyrrhizin, eine 50fach höhere
Süßkraft besitzt als Rohrzucker.
Zum Schluss aber eine Warnung!
Glycyrrhizin ist eine Droge, die vielfältige medizinische Anwendungen besitzt.
So löst es den Bronchialschleim und wirkt entzündungshemmend. Glycyrrhizin ist aber auch
eine Substanz, die keinesfalls in zu großen Mengen genossen werden darf. Sie weist
gewisse strukturelle Ähnlichkeiten mit dem Stresshormon Cortison auf. Das ist u. a.
für den Mineralstoffwechsel verantwortlich. Aus diesem Grund vermag Glycyrrhizin den
Mineralstoffwechsel zu stören und kann dadurch den Kreislauf stark beeinflussen.
Deshalb nicht zuviel Lakritz essen! Das kann Krankheitserscheinungen auslösen, wie
sie bei Kalium- und Calciummangel auftreten. Dazu gehört die Störung des Immunapparats und der
Blutgerinnung. Aber auch die Übertragung von Nervenimpulsen und die Muskelfunktionen
sind gestört. Beim Verzehr besonders großer Mengen an Lakritz soll sogar Osteoporose,
also Knochenabbau, eintreten. Die Ärzte sprechen vom "Lakritz-Syndrom".
Auch Ammonium-Ionen wirken in größeren Mengen auf den Kreislauf und auf das Zentralnervensystem; sie können zum Beispiel Hitzewallungen auslösen. Ein Grund mag wohl die physikalisch-chemische Ähnlichkeit der Ionen mit denen des Kaliums sein (gleiche Ladung, gleiche Ionenradien). Aber es gibt auch andere Gründe für die Giftigkeit von zuviel Ammonium. Klicke hier.
Trotzdem guten Appetit!
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 11. September 2012, Dagmar Wiechoczek