Prof. Blumes Tipp des Monats Juli 2002 (Tipp-Nr. 61)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Anmerkungen zu den Begriffen Anode und Kathode
Immer wieder erreichen uns Mitteilungen von wohlmeinenden Schülern, Lehrern und anderen Lesern, in denen wir auf einen vermeintlichen Fehler hingewiesen werden - so von Christoph:
Sehr geehrter Herr Prof. Blume,
in Ihrer Darstellung der Primärzelle (Daniell-Element) ist Ihnen ein Fehler unterlaufen; es
muss heissen: Kathode = Minuspol und Anode = Pluspol! Mit freundlichen Grüssen Christoph
Lieber Christoph,
Dank für den Hinweis. Sicherlich meinst du das Bild in der Webseite
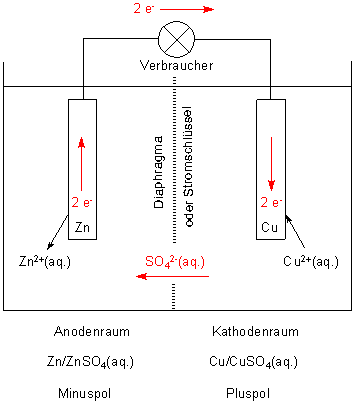
Daniell-Element.
Der Strom liefernde Kreislauf ist rot eingezeichnet
Gleich vorneweg:
Die Begriffe Anode und Kathode haben nichts mit dem Vorzeichen der Polung
zu tun
- eine Tatsache, auf die nicht nur Schüler immer wieder hereinfallen.
Hier sind die genauen Definitionen, die für jeden Elektrodenvorgang gelten:
Die Anode ist der Pol, an dem oxidierende Prozesse ablaufen.
Die Kathode ist der Pol, an dem reduzierende Prozesse ablaufen.
Das damit verbundene Pol-Vorzeichen hängt davon ab, was für ein Vorgang abläuft. Dazu unterscheiden wir die Vorgänge bei Elektrolysen (endotherm) von denen in galvanischen Elementen (exotherm).
Zur Verdeutlichung nehmen wir als Beispiel eine Zinkiodid-Lösung, in die eine Zinkelektrode und eine Graphitelektrode eintauchen. Mit dieser Anordnung kann man beide Vorgänge zeigen, denn es handelt sich hierbei um einen Akkumulator, also um ein galvanisches Element, das durch Elektrolyse wieder aufgeladen werden kann.
|
Versuch: Der Zinkiodid-Akkumulator
1 Laden des Akkus durch Elektrolyse
2 Entladen des Akkus
|
Betrachten wir zunächst die Ergebnisse der Elektrolyse
Hier stimmt scheinbar alles:
1 Die Kathode ist zugleich Minuspol, denn da wandern die positiv geladenen Kationen hin und werden unter Aufnahme von Elektronen entladen, also reduziert.
Zn2+ + 2 e- ———> Zn
2 Die Anode zieht bei der Elektrolyse die negativ geladenen Anionen an, ist also Pluspol. Die Anionen werden hier unter Abgabe von Elektronen entladen, also oxidiert.
2 I- ———> I2 + 2 e-
Nun zu den Abläufen in dem galvanischen Element
1 Am Zinkstab läuft folgender Vorgang ab, der dem
Ladevorgang entgegen läuft:
Zn ———> Zn2+ + 2 e-
Zink wird also oxidiert. Damit ist der Zink-Pol zur Anode geworden. Sie produziert jetzt Elektronen, ist also Minus-Pol!
2 Am mit Iod getränkten Graphitstab wird Iod reduziert.
I2 + 2 e- ———> 2 I-
Damit ist der Iod-Pol zur Kathode geworden. Sie saugt bei Verbindung mit dem Zinkstab Elektronen an, ist also Plus-Pol!
Beim Vergleich von Elektrolyse und Galvanischem Element kehren sich nicht die Pol-Zeichen um. Jedoch ändert sich die Richtung des Elektronenflusses, also kehren sich die Vorgänge "Reduktion" und "Oxidation" um. Das gilt letztlich dann auch für die Bezeichnungen "Anode" und "Kathode".
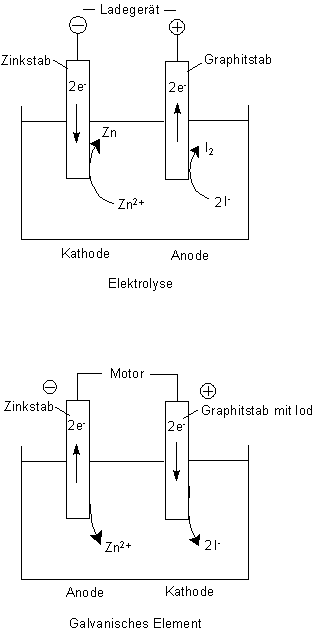
Wenn wir genau hinsehen, erkennen wir, dass das mit der Polung sowieso sehr verwirrend ist. Wir müssen bei der Elektrolyse eigentlich genau sagen, dass wir den negativen Pol des Ladegeräts an das Zinkblech anschließen, um zur Reduktion Elektronen hineinzupumpen. Diese Elektronen bekommen wir zurück, wenn wir das System als galvanisches Element schalten. Dann ist der Zinkstab wirklich Minuspol, weil er jetzt Elektronen produziert. Analog (aber umgekehrt) ist alles bei dem Graphitstab.
Wie ist es dann um die alte Definition bestellt, die ja besagt, dass an die Anode (negativ geladene) Anionen wandern, an die Kathode (positiv geladene) Kationen? In dem obigen Bild des Daniell-Elements stimmt das auch! Cu2+-Ionen wandern zur Kathode (die allerdings positiver Pol des galvanischen Elements ist) und verschwinden, da sie entladen werden. Zum Ladungsausgleich wandern Sulfat-Ionen in Richtung auf die negativ geladene Anode, an der sich Zn2+-Ionen anhäufen. Damit die Sulfat-Ionen wandern können, benötigen wir ja das Diaphragma.
Übrigens nennt man die Elektrode aus Magnesium, mit der man vor der Oxidation (Rosten) zu schützende Eisenwerkstücke negativ auflädt, "Opferanode". Man spricht hierbei gern auch vom "Kathodischen Korrosionsschutz".
Alles klar?
Mit freundlichen Grüßen
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 04. Januar 2012, Dagmar Wiechoczek