Prof. Blumes Tipp des Monats August 2011 (Tipp-Nr. 170)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Zur Löslichkeit von Alkoholen
Zum Einstieg zu diesem Tipp des Monats zitiere ich eine typische Anfrage:
| Ich sitze nun seit langer Zeit (seit fast 2 Stunden) an meinen Hausaufgaben und kann die folgende Aufgabe nicht lösen: "Erklären Sie, warum 1-Hexanol in Wasser nahezu unlöslich, in Heptan dagegen sehr gut löslich ist." |
Das Problem können wir durchaus mit schulischen Mitteln knacken. Dazu müssen wir nur ein paar kleine Experimente durchführen.
|
Versuch 1: Löslichkeit von 1-Hexanol
Bild 1: Mischungslücke
Ergebnisse:
|
Zum Vergleich mit anderen Alkoholen machen wir noch eine Reihe weiterer Versuche.
|
Versuch 2: Löslichkeit verschiedener homologer Alkohole
|
Aber auch das Mengenverhältnis von Lösemittel und zu lösendem Stoff spielt eine
Rolle
|
Versuch 3: Mengenverhältnis von Lösemittel und zu lösendem Alkohol
|
Dieses anhand unserer Experimente herausgefundene unterschiedliche Löslichkeitsverhalten der vier Alkohole lässt sich anhand der Molekülstrukturen gut erklären.
Alkohole gelten eigentlich als polare Substanzen. Wie sie sich jedoch in verschiedenen Lösemitteln verhalten, ergibt sich aus
dem Polaritäts-Gegensatz von Hydroxylgruppe und Alkylrest:
- Hydroxylgruppen sind polar,
- Kohlenwasserstoffreste dagegen unpolar.

Bild 2: Kalottenmodell von 1-Hexanol
(Foto: Blume)
| - | Die Hydroxylgruppen der Alkohole bauen zu den Wassermolekülen Wasserstoffbrücken-Bindungen auf. Das sorgt für die Löslichkeit in Wasser. (Hier beschreiben wir das mit den Wasserstoffbrücken bei den Alkoholen genauer.) |
| - | Mit Kohlenwasserstoffen wie dem Heptan gibt es nur die Möglichkeit, dass die unpolaren Alkylreste mit dem Kohlenwasserstoff in Wechselwirkung treten. Hier spielen die van der Waals-Bindungen die entscheidende Rolle. |
Die Löslichkeit von Alkoholen in dem jeweiligen Lösemittel ist offenbar eine Frage der Kettenlänge des zu lösenden Alkohols. Die Alkylreste sind beim Methanol und Ethanol so kurz, dass sie bei der Ausbildung der Wasserstoffbrücken nicht stören. Beim 1-Propanol ist die Grenze der „erlaubten Kettenlänge“ gerade erreicht.
Bleibt die Frage, warum sich die drei als hydrophil („wasserfreundlich“) geltenden niedermolekularen Alkohole auch gut in Heptan lösen. Das liegt daran, dass sich die Hydroxyl-Gruppen der Alkoholmoleküle untereinander durch Wasserstoffbrücken-Bildung „austricksen“, so dass das entstehende Molekülaggregat nach außen wie ein einziges Kohlenwasserstoffmolekül wirkt, das nur noch mit umgebenden Heptanmolekülen in Wechselwirkung tritt (-> Bild 3a).

Bild 3
Im Wasser ist es umgekehrt (-> Bild 3b): Hier bilden die Kohlenwasserstoffreste aufgrund von van der Waals-Bindungen
Aggregate, deren Hydroxyl-Gruppen nach außen zeigen und die deshalb mit Wassermolekülen Wasserstoffbrücken ausbilden können.
Sind die Kohlenwasserstoffreste wie beim 1-Hexanol zu lang, wirkt sich die Größe der zuletzt beschriebenen Aggregate so aus, dass die wenigen nach außen ragenden Hydroxylgruppen nicht mehr ausreichend mit Wassermolekülen versorgt werden können. Das ist auch eine Frage des Angebots an Wassermolekülen, also des Mengenverhältnisses von Alkohol und Wasser.
Beispiel 1-Butanol
Dieser Alkohol löst sich nicht mehr vollständig in Wasser. Mischt man Wasser und Butanol, so geht das nur kurze Zeit gut,
weil dann plötzlich eine Mischungslücke entsteht, erkennbar an der Ausbildung zweier „Phasen“ bzw.
einer Phasengrenze.
In geringen Mengen löst sich 1-Butanol durchaus noch gut in Wasser. Der Grund: Es bilden sich um die Butanolmoleküle Strukturkäfige aus Wassermolekülen (-> Bild 3). Diese Käfige werden durch Wasserstoffbrücken zusammengehalten. Die Folge ist, dass der Aufbau der van der Waals-Bindungen, die ja auf Nahordnungskräften mit sehr kleiner Reichweite beruhen, verhindert wird.
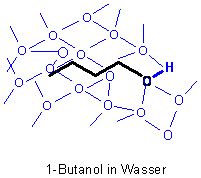
Bild 4
Je höher die Konzentration des Butanols in der Mischung mit Wasser wird, desto schwieriger ist es, genügend Wasser-Moleküle
zur Käfigbildung zu finden. Damit nimmt die Löslichkeit ab, so dass sich bereits ab etwa 10 ml (oder 7,9 g) 1-Butanol auf
100 ml Wasser die Mischungslücke ausbildet. Es entstehen zwei Phasen (-> Bild 1):
- eine dichtere („schwerere“), butanolhaltige Wasserphase (unten)
- und eine weniger dichte („leichtere“), wasserhaltige Butanolphase (oben).
Butanol löst sich aber gut in Heptan - ohne dass eine Mischungslücke entsteht. In diesem Fall überwiegt die Auswirkung der unpolaren Alkylketten, die mit den Heptanketten in van der Waals-Wechselwirkung treten.
Die Bildung der Mischungslücken ist außerdem noch eine Frage
der Temperatur
|
Versuch 4: Temperaturabhängigkeit der Mischungslücke von 1-Butanol
|
Bei steigenden Temperaturen beginnen die Butanol-Moleküle, in sich stark zu schwingen. Dadurch werden die van der Waals-Bindungen instabil. Es bilden sich mehr freie Butanol-Moleküle. Die Mischbarkeit mit Wasser nimmt deshalb zu, die Löslichkeit des Butanols in Wasser steigt also an. (Die Angabe 10 ml 1-Butanol / 100 ml Wasser bezieht sich übrigens auf 20 °C.)
Entsorgung: Die Lösungen kommen zu den (wasserhaltigen) organischen Lösemitteln.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 27. Juli 2011, Dagmar Wiechoczek
