Prof. Blumes Tipp des Monats September 2009 (Tipp-Nr. 147)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Das Gesetz von der Erhaltung der Masse (und andere kleine Lehrermogeleien...)
Ein spätberufener Lehrer, eigentlich ein Diplomphysiker, wurde an seinem Gymnasium verdonnert, neben Physik auch noch Chemie zu unterrichten. Unerfahren wie er war, musste er natürlich anderen, altgedienten Kollegen auf die Finger schauen, um zu sehen, wie man überhaupt Chemie unterrichtet. Das betraf vor allem auch die Experimentierpraxis, und das ging wohl nicht immer gut.
Richtig empört erzählte er mir nämlich die folgende Geschichte, die ich hier mit meinen Worten wiedergebe.
Ein Lehrerkollege führte ihm vor, wie er das Gesetz von der Erhaltung der Masse experimentell belegt. Dazu hatte der Kollege in einige Reagenzgläser jeweils zwei bis drei Streichholzköpfchen gelegt und anschließend die Reagenzgläser zu Ampullen zugeschmolzen. Diese Ampullen wog er vor der Klasse ab, entzündete den Inhalt mit einem Bunsenbrenner, ließ die Ampulle abkühlen und wog erneut. Siehe da, die Masse war gleich geblieben! Na ja, genau genommen bewegte sich alles nur im Rahmen der Wiegegenauigkeit… So jedoch bewies der Kollege den andächtig lauschenden Schülern, dass bei chemischen Reaktionen keine Masse verloren geht. Das imponierte dem Neulehrer, und er beschloss, es dem Kollegen gleichzutun. Er besorgte sich also leichtschmelzbare Reagenzgläser, schnitt fleißig Köpfchen von unverbrannten Streichhölzern, füllte sie in die Gläschen, die er dann zu Ampullen zuschmolz. Erwartungsvoll erhitzte er vor der Klasse die erste Ampulle. Wumm - die platzte ihm auseinander, und Glassplitter flogen ihm um die Ohren. Er nahm die nächste Ampulle, erhitzte - und so weiter. Bald war der Ampullen-Vorrat weg und der erhellende Effekt hinsichtlich des Gesetzes von der Erhaltung der Masse wohl auch. Die Schüler hatten ihren Spaß. Er ging in der Pause zum Kollegen und fragte, was da passiert sein könnte. Der Kollege staunte ihn an: „Ja, haben Sie denn nicht gesehen, dass ich beim Zuschmelzen der Ampullen immer kleine Löcher im Glas gelassen habe?“ |
Deshalb zeigen wir hier, wie man es auch ohne Mogelei richtig machen kann. Vor allem muss man an den Druckausgleich denken.
Für den sorgen wir, indem wir die entstehenden Gase sich in einen Ballon expandieren lassen. Damit ist unser System wirklich
„geschlossen“, das heißt, es kann keine Materie entweichen.
|
Versuch: Gesetz von der Erhaltung der Masse Schutzbrille (auch für die Betrachter) Wir füllen in ein Reagenzglas 20 abgeschnittene Köpfchen von unbenutzten Streichhölzern. Nun benötigen wir noch einen Luftballon. Den dehnen wir vor, indem wir ihn einmal kurz ein wenig (aber nicht zu stark!) aufblasen. Die Luft lassen wir natürlich wieder ausströmen… Dann verschließen wir das Reagenzglas erst locker mit einem Glaswollebausch, damit nach dem Anzünden keine brennenden Streichholzköpfe aus dem Reagenzglas in den Ballon springen können. Wir verschließen das Gläschen endgültig mit dem vorgedehnten Luftballon, indem wir ihn mit der Öffnung über der Reagenzglasmündung stülpen. Den Ballon befestigen wir mit einem Bindfaden oder mit Klebeband. Wir bestimmen dann die Masse des kleinen Versuchsaufbaus möglichst genau. Nun erhitzen wir das Glas von außen mit der Bunsenbrennerflamme. Nach der deutlichen Entzündungsreaktion lassen wir gut abkühlen und wiegen erneut. Ergebnis
|


Versuch zum Gesetz der Erhaltung der Masse (Fotos: Daggi)
Ein Hinweis für „Genauigkeitsfreaks“: Wenn Sie mit Mikrowaagen arbeiten, müssen Sie auch eine vorschriftsmäßige Auftriebkorrektur vornehmen, da das Volumen des Ballons zunimmt und der Ballon einen Auftrieb erfährt. Danach stimmt das Gesetz des Masseerhalts wieder.
Noch eine weitere beliebte Lehrermogelei
Beim Behandeln des Themas „Kalkbrennen“ möchten die Lehrer gern experimentell belegen, dass beim Erhitzen von Kalkstein
CO2 freigesetzt wird, gemäß
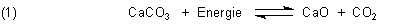
Nur - diese Reaktion funktioniert mit einem normalen Bunsenbrenner nicht, da der auf die Dauer nicht die mindestens
erforderlichen 900 °C auf die Beine bringt. (Erst bei dieser Temperatur ist der Zersetzungsdruck von Kalk gleich
dem normalen Luftdruck.) Dann ist der Effekt aber noch recht mager, weil erst einmal relativ wenig passiert. Besser
ist es deshalb, um einen sichtbaren Effekt zu erzielen, mit einem Brenner auf 1200-1300 °C hochzuheizen. Das schaffen
aber nur spezielle Spiegelbrenner.
Erfahrene Lehrer mixen deshalb für den Schülerversuch dem Kalksteinpulver vorher Natriumbicarbonat (NaHCO3) zu: Das zersetzt sich schon ab 170-180 °C.
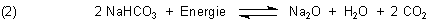
Das Gas leiten sie direkt in Kalkwasser - so fällt auch das sich bei der Reaktion (2) bildende Wasser nicht auf…
Wie gewünscht können sie somit das entstehende CO2 nachweisen… Zurück bleibt garantiert eine weiße, pulverige Substanz, mit der alle weiteren erhellenden Nachweise (z. B. auf stark alkalische Reaktion der wässrigen Aufschlämmung des „gebrannten Kalks“) erfolgreich durchgeführt werden können.
Das Problem der Schmelz-Elektrolyse von Natriumchlorid
Diese Elektrolyse funktioniert wegen des hohen Schmelzpunkts von Natriumchlorid (801 °C) unter schulischen Bedingungen
nicht. Deshalb nehmen viele Lehrer stattdessen Lithiumchlorid (Schmelzpunkt 610 °C).
Die Ergebnisse sind scheinbar völlig identisch: An der Anode riecht es eindrucksvoll nach Chlor. Die kathodisch gebildeten
Metallkügelchen sehen aus wie die von Natrium, und wie Natrium reagieren sie auch mit Wasser. Welcher Schüler merkt schon,
dass das so gebildete „Natrium“ bei der bekannten Reaktion mit Wasser weniger
heftig reagiert als gewohnt?
Manche Leute nehmen statt Natrium- oder Lithiumchlorid sogar auch Bleichlorid (Schmelzpunkt 498 °C). Aber das ist ziemlich ungesund und deshalb nicht mehr angesagt.
Weiteres
Eine andere Schote betrifft den berühmt-berüchtigten Quantitativen Versuch zur
Kupfersulfid-Synthese.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 08. Januar 2012, Dagmar Wiechoczek