Prof. Blumes Tipp des Monats Oktober 2000 (Tipp-Nr. 40)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Warum sind die Gallensäuren so wirksame Emulgatoren?
Die Grillsaison ist vorbei. Manche fette Bratwurst hat den Darm passiert. Hoffentlich ist alles gut gegangen. Erst wenn die Gallenblase erkrankt ist, merkt man, dass sie bei der Fettverdauung nötig ist. Denn die fettabbauenden Enzyme, die Lipasen, arbeiten nicht mehr, und der Stuhl ist fetthaltig und schmierig. Der Grund: Die gesunde Gallenblase sezerniert Gallensäuren in hohen Konzentrationen. Und diese wirken offenbar bei der Fettverdauung mit. Es sieht so aus, als wenn sie die Lipasen aktivieren.
|
Versuch 1: Lipase-Reaktion mit und ohne Gallensäuren
Lösungen
Durchführung
Zu Glas 1 gibt man 6 ml Natronlauge (pH 10). Es dient nur als Standard zum Farbvergleich.
Ergebnis
|
Einerseits scheinen die Gallensäuren die Lipasen direkt zu aktivieren, andererseits sind sie hervorragende Emulgatoren. Denn Lipasen arbeiten an den Grenzflächen zwischen Fett und Wasser. Emulgatoren vergrößern die Grenzflächen, indem sie Fettflächen zugunsten der Bildung kleiner Fetttröpfchen auflösen.
|
Versuch 2: Emulgierende Wirkung von Gallensäuren
Ergebnis
|
 |
| Bild 1: Emulgierende Wirkung von Cholsäuren.
Links: Öl in Wasser, rechts: Öl in Cholsäuresalz-Lösung (Foto: Daggi) |
Damit eine Substanz emulgierend wirken kann, müssen ihre Moleküle polare und unpolare
Bereiche aufweisen. Du kennst das sicherlich von den Seifen.

Das Alkyl-Ende ist lipophil, das ionische dagegen hydrophil. Auf diese Weise ist die Seife grenzflächenaktiv.
Zuvor noch ein Hinweis: Die wissenschaftliche Bezeichnung für die Gallensäuren lautet Cholsäuren (griech. chole, Galle).
Betrachten wir nun das Strukturbild des Moleküls der Cholsäure im engeren Sinne. Cholsäure ist chemisch 3a, 7a, 12a-Trihydroxy-5ß-cholan-24-säure. Sie gehört zu den Steranen.
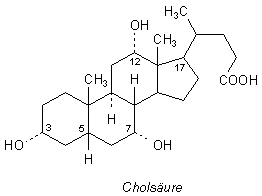
Aus diesem Bild wird nicht deutlich, warum Cholsäure so gut emulgierend wirkt. Erst wenn wir die Struktur wie im folgenden Bild dreidimensional darstellen, wird der Zusammenhang klar. Wir erkennen, dass das flächige Molekül auf der einen Seite alle unpolaren und auf der anderen alle polaren Reste trägt.
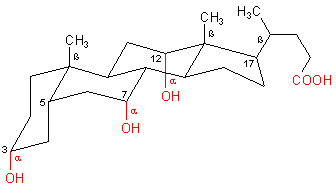
Dreidimensionales Strukturbild der Cholsäure
Ein Vergleich der Moleküle von Seifen oder Gallensäuren zeigt: Die flächigen Gallensäuren haben einen viel effektiveren Wirkungsquerschnitt als die stäbchenförmigen Fettsäuren.
Gallensäuren sind übrigens ein Abbauprodukt von Cholesterin, die wie viele andere Abbauprodukte vom Organismus noch weiterhin genutzt werden können. Die Einführung der Hydroxylgruppen und des Säurerests hat nicht nur den Effekt, dass die Gallensäuren löslicher werden und deshalb leichter ausgeschieden werden können. Physiologisch bedeutsam ist die dadurch entstandene grenzflächenaktive Wirkung.
Es gibt verschiedene Gallensäuren. Sie unterscheiden sich u. a. in Zahl und Stellung der Hydroxyl-Gruppen. Im Sekret der Gallenblase kommen allerdings nur Gallensäuren vor, die peptidartig weitere, polare Reste tragen. Die Taurocholsäuren tragen zusätzlich Taurin. Dies ist die 2-Amino-ethansulfonsäure, ein Oxidationsprodukt von L-Cystein. Taurocholsäuren sind ebenfalls stark polar. Außerdem kann auch die Aminosäure Glycin an die Cholsäure gebunden werden (Glykocholsäuren).
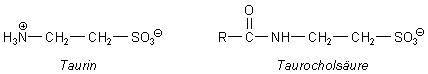
Gallensäuren sind in Wasser fast gar nicht löslich. (Gallensteine bestehen aber aus auskristallisiertem Cholesterin oder aus Calciumcarbonat.) Gut löslich sind dagegen ihre Salze. In unseren Versuchen arbeiten wir deshalb mit Gallensäuresalzen oder mit Lösungen der Säure in verdünnter Natronlauge. Übrigens werden auch von der Gallenblase die Salzlösungen abgegeben, denn der Gallensaft ist schwach alkalisch. Das wird dadurch unterstützt, dass auch der Darmsaft schwach alkalisch ist. (Beim Ansäuern des Gallensafts fallen die Cholsäuren aus, nicht aber die Tauro- bzw. Glykocholsäuren.) Durch die negative Ladung wird die Polarität der Gallensäuren und damit ihre Emulsionskraft noch verstärkt. Man spricht hier von Gallseifen, die man auch zum Reinigen von Kleidung kaufen kann. Tauro- und Glykocholsäuren sind schon im neutralen Bereich negativ geladen und deshalb anders als die Cholsäuren leicht wasserlöslich.
Für Gallensäuren gibt es einen hübschen Nachweis. Dieser stammt noch aus den Anfängen der Biochemie und wurde vor allem in Kliniken genutzt.
|
Versuch 3: Nachweis von Gallensäuren nach Pettenkofer
Ergebnis
|
 |
 |
| Bild 2: Nachweis von Gallensäuren nach Pettenkofer
(Fotos: Daggi) |
Wie Gallensäuremoleküle arbeiten
Die Wirkung von Gallensäuren (und von allen anderen grenzflächenaktiven Stoffen, den
Tensiden) auf Fett kann man sich so vorstellen: Fett kommt in Kontakt mit einer Lösung von
Gallensäuren. Diese binden sich mit ihrer lipophilen Fläche an das Fett, die hydrophile
Fläche verbleibt im Kontakt zum Wasser. Bald drängeln sich immer mehr Gallensäuremoleküle
an der Fettoberfläche. Im Bestreben, ebenfalls anzudocken, drücken sie diese auseinander.
Es bilden sich feine Fettkügelchen, und die großen Fettmassen lösen sich auf. Eine Emulsion
ist entstanden.
Aber nicht nur Fette werden emulgiert. Auch die durch die enzymatische Fetthydrolyse
entstandenen Fettsäuren oder Mono- und Diglyceride werden umhüllt und so für den Transport
aus dem Darmsaft ins Gewebe vorbereitet. Bemerkenswert ist, dass die Cholsäuren mit Fettsäuren
stabile, wasserlösliche Einschlussverbindungen (Choleinsäuren) bilden. Beispielsweise gruppieren
sich um ein Stearinsäuremolekül 8 Cholsäuremoleküle. Die so feinstemulgierten Teilchen haben
eine Größe zwischen 0,1 und 0,5 µm und werden direkt resorbiert.
Für Spezialisten
Bei der Wechselwirkung von Fett mit den Gallensäuren handelt es sich um komplizierte
Grenzflächenphänomene, für die es eine eigene Thermodynamik gibt. Stichwort: Grenzflächenpotentiale
monomolekularer Schichten. Die Grenzflächenpotentiale machen sich z. B. als Oberflächenspannung
bemerkbar. Das kann man anhand von unbenetzbaren Schwefelteilchen zeigen, die schwerer als Wasser
sind und deshalb eigentlich absinken sollten. Durch grenzflächenaktive Substanzen wie den Emulgatoren
oder Tensiden wird die Oberflächenspannung herabgesetzt. Gibt man also Gallensäuren hinzu, sinken die
Schwefelteilchen auf den Gefäßboden.
|
Versuch 4: Gallensäuren setzen die Oberflächenspannung herab
Ergebnis
|
Jedes System strebt den Zustand mit minimaler potentieller Energie an, denn der ist am stabilsten. Das gilt offenbar auch für den Zustand der Emulsion. Deshalb schieben sich die Gallensäuremoleküle geradezu begierig zwischen die beiden Phasen Wasser und Fett. Folglich ist der Prozess der Wechselwirkung des Systems Wasser/Gallensäuren/Fett auch exotherm (genau: exergon). Zur Minimierung der potentiellen Energie trägt darüber hinaus auch die Minimierung der Oberfläche bei gegebenem Volumen bei. Daher nehmen die mit Tensiden überzogenen Fetttröpfchen möglichst Kugelgestalt an.
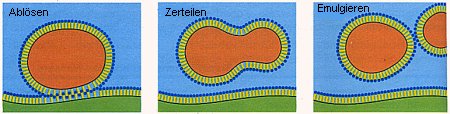 |
| Bild 3 (Quelle: Cornelsen) |
Mit welcher "Gewalttätigkeit" die Cholsäure-Teilchen die Grenzschichten monomolekular besetzen,
kann man ebenfalls in einem hübschen Experiment zeigen. Im folgenden Versuch handelt es sich um die Grenze
zwischen Wasseroberfläche und Luft. Dieses Experiment galt früher als eine Nachweisreaktion für
Gallensäuren (Nachweis nach Hay).
|
Versuch 5: Gallensäuremoleküle besetzen die Flüssigkeitsoberfläche
Ergebnis
|
 |
| Bild 4 (Foto: Daggi) |
Die hauptsächliche Wirkung der Cholsäure beruht auf einer Erhöhung der Entropie des
Systems.
Cholsäuremoleküle ohne Fettkontakt sind zunächst mit Wassermolekülen umhüllt. Das gilt auch
für die unpolare Seite!
Wenn die Cholsäuremoleküle mit Lipiden Kontakt bekommen, bilden sich van der Waals-Bindungen
zwischen den Molekülen der Cholsäure und denen des Fetts aus. Dadurch werden
von der unpolaren Seite der Cholsäuren Wassermoleküle abgedrängt. Diese sind damit
beweglicher geworden, und damit steigt die Unordnung, d. h. die Entropie nimmt zu.
(Vergleichbar hiermit ist die spontane Faltung von Proteinen unter Ausbildung von Bindungen
zwischen den nach innen gerichteten unpolaren Aminosäure-Resten.)
Die Entropie nimmt auch dadurch zu, dass statt einer einzigen Fett-Oberfläche viele kleine
Fettkügelchen mit insgesamt viel größerer Oberfläche entstehen.
Galle in der Volksmedizin
Wusstest du, dass Galle auch in der chinesischen Volksmedizin, der man so viel Rühmliches
nachsagt, genutzt wird? Zur Gewinnung von Galle gibt es spezielle Farmen, auf denen man
Bären zur Gallegewinnung anzapft - eine Tierquälerei sondergleichen.
Gallenfarbstoffe
Viele Gallensäure-Präparate, die man erwirbt, sind oft gelb oder grünlich gefärbt. Da die Präparate
aus Schlachttieren gewonnen werden, enthalten sie noch Reste von Gallenfarbstoffen.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 07. April 2015, Dagmar Wiechoczek