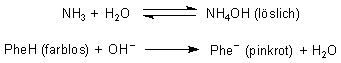Prof. Blumes Tipp des Monats Oktober 2006 (Tipp-Nr. 112)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Bunte Reihen
Unser Chemielehrer (von uns liebevoll "Hermann Bumm, der Knallgaschemiker" genannt) hatte
früher neben seinem ewigen Knallgasgetöse folgenden Trick drauf: Er stellt eine Reihe von Standzylindern
auf den Tisch. Der erste war mit einer farblosen Flüssigkeit gefüllt. Die anderen Standzylinder schienen
leer zu sein oder enthielten vielleicht vom Spülen noch etwas Flüssigkeit.
Den Inhalt des ersten Zylinders goss der Lehrer mit viel Grandezza in den zweiten Standzylinder,
wobei es eine Farbänderung oder einen Niederschlag gab. Diese neue Mischung goss er ins nächste Glas
- die Lösung wurde wieder klar oder andersfarbig. Und so ging es weiter: Bei jedem Umgießen erfolgte
ein Farbwechsel.
|
Versuch 1: Bunte Reihe
Hier sind die Angaben für 250 ml Startlösung:
Gießen Sie nun den Inhalt von Glas 1 ins zweite, die so entstandene Mischung ins dritte, diese dann ins vierte und die daraus resultierende Mischung ins fünfte Glas. Ergebnis:
|
(Zu den chemischen Hintergründen klicke hier.)
 |
| (Foto: Daggi)
Hierzu gibt es einen Film (4,8 MB) Klicke hier |
Wir nannten das "Bunte Reihen" und waren bald eifrig dabei, selbst neue zu erfinden. Anstelle von Farben
kann man auch Niederschläge erzeugen.
|
Versuch 2: Eine weitere Bunte Reihe
Hier sind die Angaben für 250 ml Startlösung:
Gießen Sie nun den Inhalt von Glas 1 ins zweite, die neue Mischung ins dritte, diese dann ins vierte und die daraus resultierende Mischung ins fünfte Glas. Ergebnis:
|
Es sind nicht nur verblüffende Experimente, die bei Elternabenden oder sonstigen Schulveranstaltungen für Spaß sorgen. Schüler können an diesen Bunten Reihen viel Chemie lernen. LehrerInnen könnten z. B. kleine experimentelle Rätsel einbringen. Die Schüler müssten dann herausfinden, welche chemischen Reaktionen da abgelaufen sind. Dazu könnten sie auch die Reaktionsgleichungen aufstellen. Das sind z. B. die Reaktionen bei der zweiten Bunten Reihe:
|
Glas 1 enthielt eine verdünnte Lösung von Silbernitrat. Bildung des Niederschlags in Glas 2: AgNO3 (löslich) + NaCl (löslich) ———> AgCl (fest) + NaNO3 (löslich) Auflösung des Niederschlags in Glas 3: AgCl (fest) + 2 NH3 ———> [Ag(NH3)2]Cl (löslich) Die Pinkfärbung in Glas 4 beruht auf dem Gehalt an Phenolphthalein (PheH), das mit der restlichen Base Ammoniak bzw. den Hydroxid-Ionen reagiert:
Die Entfärbung in Glas 5 beruht auf einer weiteren einfachen Säure/Base-Reaktion. Die führt letztlich auch zur Reaktion mit dem farbigen Indikator-Anion. NH4OH (löslich) + HCl (löslich) ———> NH4Cl (löslich) + H2O Phe- (pinkrot) + HCl (löslich) ———> PheH (farblos) + Cl- (löslich) Da dabei auch der Silber-Ammoniak-Komplex zerlegt wird, bildet sich wieder schwerlösliches Silberchlorid - wegen der Salzsäure in größerer Menge als oben. |
Die Schüler könnten auch selbst Lösungen und Verdünnungen herstellen. Ein Hinweis: Wer es ganz exakt haben will, verwendet molare Lösungen. Beim Berechnen müssen Sie immer bedenken, dass die Startlösung wegen der großen Lösungsmenge entsprechend verdünnter sein muss.
Wenn Schüler selbst bunte Reihen erfinden wollen, sollten sie mit kleinen Reihen beginnen. Für den Schülerversuch reichen natürlich kleinere Gefäße und Tropfpipetten aus.
Schicken Sie uns die Rezepte Ihrer bunten Reihen. Wir wollen diese gern hier veröffentlichen. Deshalb sagen Sie uns auch, ob wir Ihre Erfindernamen dazu setzen dürfen.
Eine Einschränkung: Wir haben schon eine Menge Bunter Reihen vorgestellt. Da ist z. B. die Farbreihe der Sulfide oder die Rotkohlsaftreihe. Hier haben wir aber immer die gleiche Lösung zugegeben. Diese bunten Reihen meinen wir hier deshalb nicht.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 14. August 2008, Dagmar Wiechoczek