Prof. Blumes Bildungsserver für Chemie
Prof. Blumes Bildungsserver für Chemie
Tipp des Monats Juni 2017 (Tipp-Nr. 240)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Wolfram Keil
Folgende Schlagzeile fiel mir im Juni 2015 am Zeitungskiosk ins Auge. „Hier hat LEHRER KRAWUMM Chemie unterrichtet“ [1], [2]. Im Hintergrund das Bild einer verwüsteten, verkohlten und vom Löschwasser durch-nässten Chemie-Sammlung [3]. Mit „BILD“-typischer, dramatischer Wortwahl wurde über eine Gerichtsverhandlung nach einem Chemie-Unfall an einem Hamburger Gymnasium im Dezember 2014 berichtet. Der betroffene Lehrer hatte den bekannten und erprobten Versuch zur „Vergoldung“ einer Kupfermünze („Transmutation“) durchgeführt. (Über den Versuch und dessen chemischen Hintergründe berichten wir auf einer besonderen Webseite.) Nach erfolgreicher Versuchsdurchführung entsorgte der Lehrer die abgekühlten und nassen Zinkreste in einem Abfalleimer in der Sammlung. Nach etwa zwei Stunden brach ein Feuer aus, das wohl zunächst unbemerkt blieb und einen Schaden von etwa 67 000 Euro verursachte. Der Lehrer erhielt daraufhin eine Geldstrafe wegen fahrlässiger Brandstiftung in Höhe von 5000 Euro. Dagegen legt er Widerspruch ein. Er berief sich vor Gericht darauf, dass eine chemische Reaktion stattgefunden haben muss, die er nicht voraussehen konnte. Wegen unklarer Beweislage und ungenauer Ermittlung der Brandursache wurde er freigesprochen. Glück gehabt… Mir sind auch aus persönlichen Gesprächen mit Kollegen anderer Schulen ähnliche Geschichten von Beinahe-Unfällen mit schwelenden oder bereits brennenden Papierkörben nach dem „Transmutations“-Versuch bekannt, die jedoch glücklicherweise alle noch rechtzeitig entdeckt und gelöscht werden konnten, bevor ein ernsthafter Schaden eingetreten war. In den mir bekannten Versuchsvorschriften zu diesem beliebten Experiment finden sich nur in den seltensten Fällen Hinweise auf eine ja zumindest gelegentlich auftretende Gefahr. Aber was ist in all diesen Fällen schief gegangen? Diese streitbare Problemstellung lässt man kurz in den Schülerköpfen wirken und bietet dann den berechtigten Zweiflern an, dies am Beispiel der Umwandlung von Kupfer in Gold vorzuführen.
Gewitzte Schüler stellen hier manchmal die Frage, warum man denn noch als Lehrer arbeiten würde, wenn man in der Lage wäre, Kupfer in Gold umzuwandeln. In diesem Fall verweist man auf den angeblich sehr hohen Preis der beiden benötigten Chemikalien…
Nach optischen Kriterien gelingt die „Transmutation“ nach etwas Übung problemlos. Bemerkenswert ist, dass die Umwandlung von Kupfer zu Gold über „Silber“ als Zwischenstufe verläuft (siehe hier). Ein besonders goldähnlicher Glanz entsteht durch Abschrecken der in der Brennerflamme umgewandelten Münzen mit kaltem Wasser. Jetzt hat man die Schüler endgültig am Haken. Könnte es vielleicht doch möglich sein…? Nach erfolgreicher Umwandlung des Kupfers über „Silber“ in „Gold“ gibt man den glücklichen Spendern der Kupfermünzen die nun scheinbar deutlich im Wert gesteigerten „Gold“münzen zurück, verbunden mit der Hausaufgabe für alle, Eigenschaften von Gold zu recherchieren, mit deren Hilfe man - mit den Möglichkeiten der Schule - die Echtheit der „Gold“münzen beweisen oder widerlegen könnte. Die Möglichkeit, vielleicht echtes Gold geschenkt bekommen zu haben oder einen Lehrer der Flunkerei zu überführen, hat ein durchaus hohes Motivationspotential. Nach meinen Erfahrungen ist dies die Chemiehausaufgabe, die - im Vergleich zu anderen Hausaufgaben - vom höchsten Prozentsatz der Schüler erledigt wird. In der nächsten Stunde trägt man dann die Vorschläge der Schüler zusammen und überprüft sie - wenn möglich - experimentell. In einigen offensichtlichen Eigenschaften wie: Farbe, Biegsamkeit, Härte, elektrische Leitfähigkeit, Magnetismus, Löslichkeit in Königswasser usw. sind sich Gold und Messing ähnlich bis gleich. Für die Prüfung von Biegsamkeit und magnetischem Verhalten bietet sich die Verwendung eines „vergoldeten“ Kupferblechs an, denn die Münzen sind natürlich - wie auch echte Goldmünzen - nicht biegsam und die Centmünzen sind wegen eines Stahlkerns magnetisch. Die Vorschläge der Schüler müssen natürlich so geordnet werden, dass der Versuch, der den „Betrug“ entlarvt, als letzter durchgeführt wird. Dies wird in den meisten Fällen die Messung der Dichte sein. Die Dichte der „vergoldeten“ Münzen lässt sich auf verschiedene Arten ermitteln. Man kann das Volumen der Münze als Zylinder annehmen, vermessen und berechnen oder mit Hilfe der Wasserverdrängung (z.B. von 10 Münzen) ermitteln. Am elegantesten ist es jedoch, eine echte Goldmünze in der Größe einer der verwendeten Centmünzen zu beschaffen (z.B. American Eagle ¼ Unze 10$ hat etwa die Größe einer 5-Cent-Münze) und auf einer Balkenwaage miteinander zu vergleichen. Zwei gleich große Münzen aus demselben Material müssen auch gleich schwer sein. Tatsächlich reichen selbst zwei der „vergoldeten“ Münzen nicht aus, um eine echte Goldmünze aufzuwiegen. Die Unterschiede zum Vergleich der Dichtewerte der Reinstoffe ergeben sich aus der Tatsache, dass Goldmünzen nicht aus reinem Gold sind und somit auch eine geringere Dichte haben. Die Centmünzen haben alle einen Stahlkern und weichen dadurch auch von der Dichte des reinen Kupfers ab. Nun ist die Welt der Schüler wieder in Ordnung, auch wenn wir nun leider doch kein Kupfer in Gold umgewandelt haben. Ohne es zu merken haben die Schüler an einem motivierenden Beispiel erkannt, dass sich Stoffe an ihren Eigenschaften erkennen lassen, dass Eigenschaften, die sich mit konkreten Zahlen messen lassen, dazu besser geeignet sind und dass manche Eigenschaften bei mehreren Stoffen gleich sein können. Zwei Proben sind nur dann aus dem gleichen Stoff, wenn sie in allen Stoffeigenschaften übereinstimmen. Findet man nur eine Eigenschaft, in der sie sich unterscheiden, sind es zwei unterschiedliche Stoffe. Bei der Betrachtung der Gefahrenhinweise auf einer Flasche mit Zinkpulver sieht die Sache schon anders aus. Es finden sich Hinweise zur Entzündlichkeit, da es als relativ unedles Metall in Pulverform durch die große Oberfläche stark exotherm mit Sauerstoff reagieren kann, sowie zur Giftigkeit für Wasserorganismen, da Zink ein Schwermetall ist. Über Versuche mit Zinkpulver berichten wir auf einer besonderen Webseite. Welchen Sinn hat es also das edlere Eisen mit dem unedleren Zink zu beschichten? An feuchter, kohlenstoffdioxidhaltiger Luft bildet Zink eine dichte, witterungsbeständige, graue Schutzschicht aus Zinkhydroxid und -carbonat mit der ungefähren Zusammensetzung Zn5(OH)6(CO3)2, die weitere Korrosion verhindert. Hier kommt also der Effekt der Passivierung zum Tragen, den wir auch von anderen unedlen Metallen wie Aluminium und Chrom kennen. Wenn das molare Volumen des Metalls und der Passivierungsschicht nicht zu weit auseinander liegen, schützt die Schicht auch unedle Metalle vor dem Sauerstoff der Luft und somit vor weiterer Korrosion. Beim Eisen hat eine sich bildende Rostschicht ein deutlich größeres molares Volumen als das Eisen, platzt dadurch ab und kann so keine Schutzwirkung entfalten. Die Beschreibung eines vergleichbaren Brandes und eindrucksvolle Bilder zu einem entsprechenden Brandversuch mit feuchtem Zinkpulver in einem Kunststoffabfalleimer findet man auf der Webseite der Feuerwehr Bächingen [5]. Aber auch eigene Versuche mit Küchenkrepp, mit dem die anhaftenden feuchten Zinkreste von den Münzen gewischt worden waren, zeigen, dass selbst kleine Mengen an aktiviertem Zinkpulver unter ungünstigen Bedingungen einen Brand verursachen können. Bild 1: Brandlöcher im Küchenkrepp
Der Küchenkrepp wurde in einer feuerfesten Schale gelagert und nach 2 Stunden kontrolliert. An einigen, aber nicht an allen Stellen, an den sich Zinkanhaftungen befanden, hatten sich Brandlöcher gebildet. Zu offenen Flammen kam es bei dieser Versuchsdurchführung nicht. Bilder 2 & 3: selbstlöschende Abfalleimer (15 L (links) & 60L (rechts))
Selbstlöschende Abfalleimer gibt es von unterschiedlichen Herstellern in verschiedenen Farben und Größen. Das Prinzip der Löschwirkung ist einfach und außerordentlich schnell wirksam. Bild 4: Funktionsweise eines selbstlöschenden Abfalleimers
Aufgrund der besonderen Form des Deckels entstehen im Falle eines Brandes durch die aufsteigenden Brandgase Verwirbelungen, die den Zutritt des Sauerstoffs von außen innerhalb weniger Sekunden unterbinden. Video: Brennendes Papier in selbstlöschendem Abfalleimer
Der Kern des instabilen 197Hg fängt nun im zweiten Schritt ein Elektron aus einer kernnahen Schale der eigenen Hülle ein. Dadurch entsteht das stabile 197Au, und ein Elektron-Neutrino wird emittiert. Unglücklicherweise ist dieser technisch mögliche Vorgang wirtschaftlich völlig uninteressant. Für die Reaktion benötigt man Kernreaktoren mit hoher Neutronenflussdichte und lange Bestrahlungszeiten. Das benötigte 196Hg ist im natürlichen Quecksilber nur zu etwa 0,15% enthalten. Weitere Quecksilber-Isotope bilden radioaktive Gold-Isotope, die mit kurzen Halbwertzeiten weiter zerfallen und aufwendig abgetrennt werden müssten. Der Preis des so künstlich hergestellten Goldes ist dadurch um ein Vielfaches höher als der des natürlichen Goldes. Ein kleines Klümpchen des künstlichen Goldes wurde 1955 auf der Genfer Atomkonferenz ausgestellt und befindet sich seitdem im Museum of Sciences und Industry in Chicago. Im Chemieunterricht müssen wir uns also leider weiterhin mit Messing als Goldimitat bescheiden. Aber wenn man aber rein mathematisch vorgeht und die Ordnungszahlen von Kupfer und Zink addiert (29 + 50 = 79), erhält man auch die Ordnungszahl von Gold. Zufall? ;-)
Das „Vergolden“ von Kupfermünzen
Die scheinbare „Transmutation“ von Kupfer- in Goldmünzen ist ein beliebter Versuch im Anfangsunterricht [4]. Bei der Einführung der Stoffeigenschaften kann man sehr elegant die Aufmerksamkeit der Schüler auf sich ziehen, indem man nach ein paar Geschichten über die Ziele der Alchemie im Brustton der Überzeugung behauptet, dass es heutzutage kein Problem mehr sei, aus unedlen Metallen Gold herzustellen.
Wenn man gut vorbereitet ist, hat man zwei mit scheinbar professionellen Etiketten beschriftete Chemikaliengefäße z. B. „Transmutan Cu I (Lösung) zur Umwandlung von Kupfer in Gold“ für die Natriumhydroxid-Lösung und „Transmutan Cu II (Pulver)…“ für das Zinkpulver. Solche Pseudo-Etiketten lassen sich mit Grafikprogrammen in kurzer Zeit durch Veränderung von Original-Etiketten erstellen.
Um dem Vorwurf am Kupfer etwas manipuliert zu haben, aus dem Weg zu gehen, verwendet man neben einem Stück Kupferblech auch einige kupferne Centmünzen, die idealerweise von den Schülern zur Verfügung gestellt wurden.
Zink – ein Gefahrstoff?
Zink kommt in der Alltagswahrnehmung - in Form von Korrosionsschutzbeschichtungen für Stahl (Dachrinnen, Geländer…), als Zinksalbe (die eigentlich eine Zinkoxidsalbe ist) oder als Brausetabletten mit Zink - nicht als Gefahrstoff vor und scheint eher eine Schutzwirkung zu entfalten.
Papierkorbbrand
Zurück zur Eingangsfrage. Was hat denn nun den Brand verursacht? Das käufliche Zinkpulver ist oft stabilisiert, also mit der oben genannten Schutzschicht überzogen. Es entzündet sich somit auch nicht spontan an der Luft. Beim „Vergoldungs“-Versuch kochen wir nun das passivierte Zinkpulver in Natrium- oder Kaliumhydroxidlösung und lösen dadurch die Schutzschicht auf. Was für das Versuchsziel nützlich ist, wird nun aber bei der Entsorgung zum unterschätzten Problem. Aus Umweltschutzgründen (giftig für Wasserorganismen) sollte man das übriggebliebene Zinkpulver nicht in den Ausguss schütten. Da es bei der Entsorgung nass und kalt ist, erscheint es aber nicht abwegig, es in den Hausmüll zu geben. Nun handelt es sich aber hier nicht mehr um stabilisiertes, sondern - durch Entfernen der Schutzschicht - um aktiviertes Zinkpulver. Dieses wirkt nun wie ein - wenn auch „unzuverlässiger“ - Zeitzünder. Solange es noch nass ist, kann es nicht heißer als 100°C werden, und das Wasser behindert zusätzlich den Kontakt zum Sauerstoff. Je nach Bedingungen verdunstet das Wasser und/oder wird von ebenfalls im Abfalleimer liegenden Papierhandtüchern unterschiedlich schnell aufgesogen. Innerhalb von Minuten bis Stunden erhitzt sich das aktivierte Zinkpulver bei der Ausbildung einer neuen Oxidschicht so stark, dass es weitere Papierhandtücher oder andere brennbare Stoffe entzünden kann. Da die Trocknung des Zinkpulvers einige Zeit dauert, ist möglicherweise inzwischen auch niemand mehr im Raum, der den Brand in der Entstehungsphase bemerken und rechtzeitig löschen könnte. Aus Kostengründen finden wir in Schulen leider oft Abfalleimer aus Kunststoff, welche die Ausbreitung eines Brandes weiter fördern.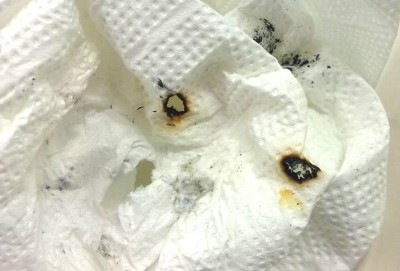
(Foto: Keil)
Lösungsvorschläge
Dieser Versuch ist viel zu schön, um ihn zu meiden, aber bei der Entsorgung sollten folgende Sicherheitsempfehlungen beachtet werden: Sowohl die Zinkreste als auch Küchenkrepp mit Zinkanhaftungen dürfen nicht im feuchten Zustand im Hausmüll entsorgt werden. Sie sollten in feuerfesten Gefäßen an der Luft trocknen z. B. im Abzug. Nach dem Trocknen hat sich die Schutzschicht erneut gebildet und das Gefahrenpotential drastisch verringert. Reste des Zinkpulvers können außerdem in einem geschlossenen und beschrifteten Gefäß aufgehoben und nach Zugebe von etwas „frischem“ Zinkpulver für weitere „Transmutations“-Versuche wiederverwendet werden. Grundsätzlich sollten in Chemieräumen keine Abfalleimer aus Kunststoff verwendet werden. Empfehlenswert und im Verhältnis zu einem Brand unschlagbar günstig sind selbstlöschende Abfalleimer.

(Fotos: Keil)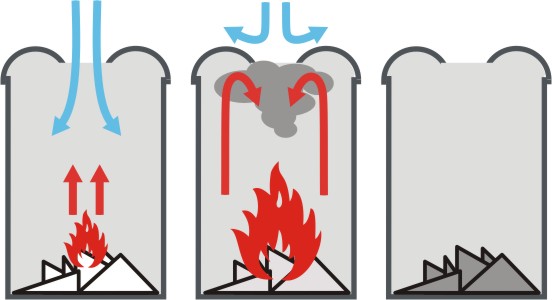
(Foto: Keil)
(Video: Keil)
Aber ist die Elementumwandlung unedler Metalle zu Gold überhaupt möglich?
Den Physikern Inghram, Hess und Heyden gelang 1947 tatsächlich erstmals die Umwandlung eines unedleren Metalls in Gold [6]. Allerdings nicht durch eine chemische Reaktion, sondern durch Kernreaktion. Quecksilber wurde dabei im Kernreaktor mit langsamen Neutronen bestrahlt. Natürliches Quecksilber ist allerdings ein Gemisch aus sieben stabilen Isotopen. Nur aus dem Isotop 196Hg entstand dabei das einzige stabile Gold-Isotiop 197Au. Im ersten Schritt fängt der Kern des 196Hg ein Neutron ein und wandelt sich unter Aussenden von Υ-Strahlung in das instabile 197Hg* um.

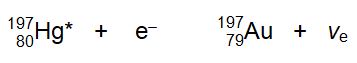
Quellen:
[1] Wieberneit A. Bild-Zeitung (Hamburg) 09.07.2015
[2] http://www.bild.de/regional/hamburg/prozesse/hier-hat-ein-lehrer-krawumm-chemie-unterrichtet-41694170.bild.html (abgerufen am 02.06.2017)
[3] http://www.bergedorfer-zeitung.de/bergedorf/article135588849/Flammen-im-Chemieraum-Schulschluss.html (abgerufen am 02.06.2017)
[4] Nickel H. MNU. 05/2001; S. 284ff.
[5] http://www.ffw-baechingen.de/brennpunkt/brandgefahren-21-30/#Teil_24 (abgerufen am 02.06.2017)
[5] Hoffmann K. Kann man Gold machen?, Urania Verlag, Leipzig 1982, S. 185ff.
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 16. Juni 2017, Fritz Meiners