Prof. Blumes Tipp des Monats März 2010 (Tipp-Nr. 153)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Chemie mit Zinkpulver
Das Schwermetall Zink hat in Pulverform das Gefahrensymbol (F), was darauf hinweist, dass es erstaunlich unedel ist.
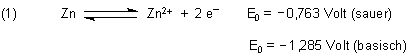
Man kann mit ihm viele schöne Experimente machen, die oftmals Wunderstunden bereichern. Man kann aber
auch einiges über Redoxreaktionen, Aktivierung und Katalyse lernen.
Hinweise zum Zinkpulver
Wegen seiner Brennbarkeit gibt es zwei Zinkpulverformen. Die eine ist brennbar; sie ist nicht stabilisiert.
Mit dieser Pulverform funktionieren die Versuche, die wir hier vorstellen, am besten. Dieses Pulver hat aber
auch den Nachteil, dass es sehr schnell verdirbt. Dabei überzieht es sich mit einem Belag von Hydroxiden,
Oxiden sowie Carbonaten.
Das andere Zinkpulver ist durch Vorbehandlung der Oberfläche stabilisiert („phlegmatisiert“) worden. Die
Versuche, die wir hier vorstellen, sollten dennoch auch mit diesem Pulver funktionieren, wenn es nicht zu stark
„vergammelt“ ist.
Auf jeden Fall sind Behälter, in denen Zinkpulver aufbewahrt wird, nach Entnahme des Zinks sofort wieder luftdicht zu verschließen.
Nun zu den Versuchen
Versuch 1
Beim wohl bekanntesten Versuch mit Zinkpulver, dem „Feuerball“, müssen wir kräftig aktivieren, indem wir das
an sich ziemlich stabile Gemenge aus Zink und Schwefel entzünden.
|
Zink und Schwefel
Vorsicht! Diese Reaktion darf wegen der Explosionsgefahr nicht in einem Reagenzglas gestartet werden! Ergebnis:
|

(Foto: Daggi)
Die Reaktion ist formal ein Redox-Vorgang zwischen Zink und einem Nichtmetall, hier Schwefel (2a). Allerdings
bildet sich aufgrund der Reaktionswärme daneben zusätzlich viel Zinkoxid. Man kann auch sagen, dass das zunächst
gebildete Zinksulfid verbrennt (2b). Vermutlich werden beide Reaktionen nebeneinander ablaufen.
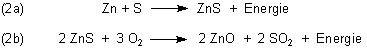
Versuch 2
Bei anderen Mischungen reicht es auch aus, zur Auslösung der Reaktion etwas Wasser zuzutropfen, statt zu erwärmen.
Hier folgen zwei Beispiele.
|
Zink und Iod
Ergebnis:
|
In erster Linie handelt es sich um eine einfache Redoxreaktion zwischen Zink und einem Halogen, Iod. Diese Reaktion
ist jedoch gehemmt, was man daran erkennt, dass die trockene Mischung stabil ist. Anders ist das, wenn etwas
Wasser zugetropft wird. Das sieht nach Katalyse aus. Aber was ist Katalysator?
Um die Frage zu beantworten, sollte man zunächst die Reaktionsgleichungen so formulieren:
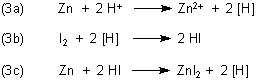
Wasser enthält einige Protonen, die zunächst mit dem unedlen Zink reagieren (3a). Es bildet sich Wasserstoff in „statu nascendi“ (Symbol [H]). Darunter versteht man Wasserstoffatome bzw. Wasserstoffradikale, die gleich nach ihrer Entstehung mit Iod reagieren (3b). Dabei bildet sich Iodwasserstoff, dessen Protonen mit Zink reagieren (3c) - und so weiter.
Es handelt sich bei der Reaktion von Versuch 2 also um eine Protonenkatalyse, bei der die Aktivierungsenergie gegenüber dem Versuch 1 deutlich herabgesetzt ist.
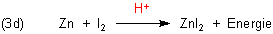
Es gibt daher auch die Möglichkeit der Formulierung des Gleichungssystems (3a-d) als Katalysekreisprozess (3e).
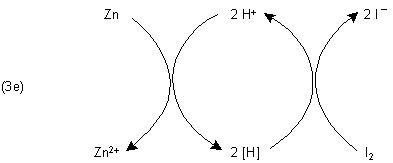
Beispiele für Protonenkatalysen gibt es reichlich, z. B.:
- Estersynthese
- Spaltung von Disacchariden oder von Polysachariden
Versuch 3
Der folgende Versuch zeigt, dass ein Reaktionsstart statt mit flüssigem Wasser sogar auch mit Eis möglich ist. Daraus
folgt, dass bei der notwendigen Aktivierung nicht so sehr die Wärmezufuhr im Vordergrund steht, sondern offenbar auch hier an
eine Katalyse zu denken ist.
|
Zink und Ammoniumsalze
Ergebnis:
|
Der Rauch enthält Zinkchlorid und Zinkoxid, Stickoxide und Ammoniak.
Bei dieser Reaktion reagieren zunächst die Protonen der sauren Ammonium-Ionen mit dem Zink, wobei Zinkchlorid und Zinknitrat entstehen (4a). Die sich bildenden Wasserstoffatome [H] reduzieren die Nitrat-Ionen (4b). Durch die Reaktionshitze bildet sich auch Zinkoxid.
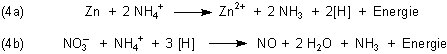
Der Katalyseprozess ist hier nicht so deutlich zu erkennen. Im Mittelpunkt steht jedoch das Wasser, welches erst ermöglicht, dass die Protonen des Ammoniums mit dem Zink reagieren können. Da Wasser während der Reaktion (4b) entsteht, handelt es sich um eine sich selbst beschleunigende Reaktion, um eine Autokatalyse.
Versuch 4
Beim folgenden Experiment müssen wir kein zusätzliches Wasser hinzugeben, weil in den Kupferchlorid-Kristallen bereits
genügend Hydratwasser gebunden vorliegt.
|
Zink und Kupfer(II)-chlorid-Dihydrat
Ergebnis:
|
Hier findet die bekannte Redoxreaktion zwischen Kupfer-Ionen mit einem unedlen Metall statt (5). Der Versuch wird durch Chlorid-Ionen katalysiert. (Aus diesem Grunde ist Lösungswasser notwendig.) Deshalb funktioniert er auch nicht mit Kupfer(II)-sulfat-Pentahydrat.
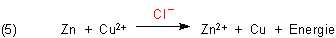
(Zum analogen Verhalten von Kupferchlorid mit Aluminium klicke hier.)
Versuch 5
Der Austausch von Halogenatomen ist auch mit organisch-chemischen Verbindungen möglich. Hier wird wieder durch
Wärmezufuhr aktiviert.
|
Zink und Tetrachlorkohlenstoff
Ergebnis:
|
Der weiße Nebel besteht aus wasserfreiem Zinkchlorid. Der schwarze Rückstand ist Kohlenstoff.
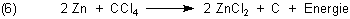
Genau genommen handelt es sich bei (6) um eine extreme Eliminierungsreaktion.
Mit dieser Mischung erzeugte man früher Nebel („Nebelkerzen“), die allerdings nach einigen Unfällen zumindest in der Bundeswehr aus dem Verkehr gezogen wurden. Grund ist das Zinkchlorid, das in der Lunge unter Bildung von Salzsäure hydrolysiert wird. Formal kann man das so beschreiben (7):
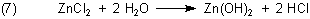
Versuch 6
Bei der Aufzählung der Verwendung von Zinkpulver darf keinesfalls der bekannte Versuch „Kupfermünzen vergolden“ fehlen.
Hier findet genau genommen aber gar keine chemische Reaktion statt. Es handelt sich nur um die Mischung zweier Metalle,
also um die Herstellung einer goldartig aussehenden Legierung, nämlich Messing.
Versuchsvorschrift und Erklärung finden Sie im Tipp des Monats Nr. 17.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 24. Februar 2010, Dagmar Wiechoczek