Prof. Blumes Bildungsserver für Chemie
Tipp des Monats Juli 2017 (Tipp-Nr. 241)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Thermochrome Farben, die beim Laminieren verschwinden – Zauberei?
Jens Schorn
Zur Verschönerung und Gestaltung des Chemieraums in der Schule sollten bunte Bilder zur Markierung von Inventar und Arbeitsbereichen hergestellt werden. Schnell waren hierzu bunte Stifte, Papier und ein Gerät zum Laminieren beschafft. So sollten bleibende Farbbilder entstehen, die man durch das Laminieren vor Wasser und anderen Verunreinigungen schützen wollte. Das Laminiergerät sorgt dafür, dass Papier, das zwischen zwei thermoplastischen Kunststofffolien liegt, bei einer bestimmten Temperatur mit den Kunststofffolien verschmolzen wird. Die „bunte Chemie“ war schnell hergestellt und ebenso schnell ins Laminiergerät eingeschoben. Bild 1: Bunte Chemie vor dem Laminator
Bild 2: Bunte Chemie im Laminator
Oje!! Die ganze Mühe umsonst. Die Farbenfreude war dahin.
Erste Beschreibungen der Veränderungen von Farben unter dem Einfluss von Wärme stammen aus den 1950er Jahren [1]. Dort werden organische Farbstoffe, sogenannte „thermochromic ethylenes“, beschrieben, wie sie bei steigender Temperatur ihre Konformation ändern. Dabei handelt es sich um eine Strukturveränderung, bei der sich lediglich die räumliche Anordnung der Atome zueinander ändert. Die Verbindungen von Atom zu Atom bleiben bei unterschiedlichen Konformeren aber bestehen. Die von J.F.D. Mills und S.C. Nyburg [2] beschriebenen Strukturen zeigten bei Raumtemperatur keine oder nur eine geringe Farbigkeit. Das änderte sich dann bei höheren Temperaturen. Die Moleküle absorbierten stark im sichtbaren Bereich des Lichtspektrums und zeigten dadurch eine Farbigkeit. Die Erklärungen für die Farbänderungen können aber auf unseren Fall nicht angewendet werden, da hierbei die Farben bei Temperaturen, die beim Laminieren auftreten, verschwinden. Es gibt viele Anwendungsbereiche, in denen es wichtig ist, dass bei hohen Temperaturen eine entstehende oder verschwindende Farbe z. B. vor besonders großer Hitze warnt. Solche Anwendungen oder Anwendungen im Bereich des Designs trifft man auch im Alltag [3]. Bild 3a-c: „Chemie im Kontext“ Tasse
All diese Phänomene werden unter dem Begriff Thermochromie zusammengefasst. Die Ursachen dafür sind Änderungen in der Kristall- oder Molekülstruktur. Sucht man im Schreibwaren- oder Bastelbedarf nach thermochromen Farben, so kommt man an einer japanischen Firma namens Pilot nicht vorbei, die schon seit den 1970er Jahren erste Patente [3] auf die Entwicklung von „radierbaren“ Farbstiften besitzt. Bild 4: Bunte Stifte
Studiert man diese Patente, so erkennt man, dass sich die Tinten immer aus drei Bestandteilen zusammensetzen: Der erste Teil (Komponente A) besteht immer aus dem eigentlichen Farbstoff, der Protonen je nach Reaktionspartner Protonen aufnimmt (also als Base funktioniert) oder Protonen abgibt (also als Säure funktioniert).
Man kann man das in einer allgemeinen Gleichgewichtsreaktion wie folgt ausdrücken. Schaut man in den Patenten der Firma Pilot nach, so findet man für die verwendeten Farbstoffe sehr komplexe Strukturen und Namen [4]. Diese Stoffe gehören meist zu den Triphenylmethanen oder den Fluoranen. Ein Beispiel für einen Triphenylmethanfarbstoff ist das bekannte Phenolphthalein. Es besitzt in stark saurem Milieu eine rote Farbe (1). Wer verstehen will, wieso die folgenden Strukturen mal farbig und mal nicht farbig sind, der stöbert bitte auf dieser Seite unter dem Stichwort „Das Phenolphthalein-Molekül genauer betrachtet“. Phenolphthalein im roten Zustand bei sehr niedrigem pH-Wert
Um den Farbstoff nun in die farblose Form (2) zu bringen, muss ihm ein Proton (H+) entzogen werden. In unserem Beispiel erfolgt dies an der Carboxylgruppe (rot gekennzeichnet) (1). Phenolphthalein im farblosen Zustand
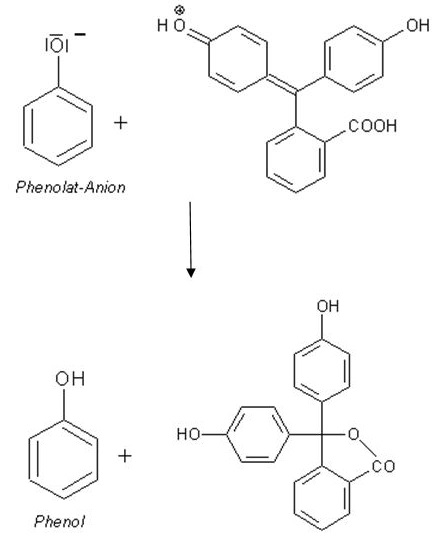
Dies gelingt mit einer Base. Genau aus einem solchen Stoff besteht der zweite Teil der Tinte (Komponente B). Ein Beispiel hierfür ist das 4-tert-Butylbrenzcatechin (3). Struktur von 4-tert-Butylbrenzcatechin Solche Stoffe verhalten sich bezüglich der Hydroxylgruppen ähnlich wie Phenol und können nach Abgabe des Protons an der Hydroxylgruppe auch als sogenanntes Anion vorliegen. (Quelle: http://www.chemieunterricht.de/dc2/phenol/sre.htm) Reagiert nun das Phenolat-Anion mit der Komponente A einer Farbstifttinte, so verliert das Farbstoffmolekül sein Proton und der Farbstoff damit seine Farbigkeit (4).

(Foto: Schorn)
(Foto: Schorn)
Was ist hier geschehen?
Wie kann man die Farbigkeit wiedergewinnen?
Kann man hier von Zauberei sprechen?

(Foto: Schorn)
(Foto: Schorn)
Wieso verschwinden nun die Farben?
Zur Erinnerung: Eine Base ist nach der Definition von Brönsted eine Verbindung, die in der Lage ist, ein Proton aufzunehmen. Man spricht hier von einem Protonenakzeptor. Diese Verbindungen besitzen hierzu freie oder auch nichtbindende Elektronenpaare, um freie Protonen aus einer Lösung aufzunehmen. Deshalb handelt es sich bei der Komponente A in den Tinten um einen Elektronendonator.
Bindet der Farbstoff ein Proton, so liegt er in der farbigen Form vor. Gibt er das Proton ab, so verliert oder verändert er seine Farbe.

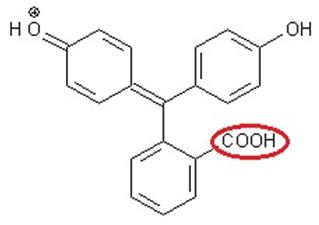
(Quelle: http://www.chemieunterricht.de/dc2/tip/11_06.htm)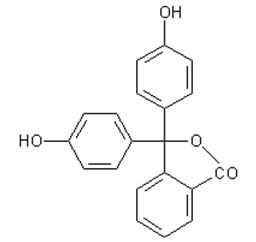
(Quelle: http://www.chemieunterricht.de/dc2/tip/11_06.htm)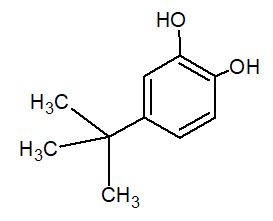
Wieso findet die Entfärbung bei bestimmten Temperaturen statt?
Genauer geht es natürlich mit einer Apparatur zur Schmelzpunktbestimmung.
Klick mich an!
Bild 6a - 6c: Entfärbung mit Apparatur
(Foto: Schorn)
Hierzu muss man die Tinte allerdings jeweils in eine Glaskapillare einfüllen.

Bild 7a - 7b: Farbe in Kapillare vor (links) und nach dem Erhitzen bis auf 62 °C (rechts)
(Foto: Schorn)
Die Beobachtungen zeigen Entfärbungen bei unterschiedlichen Temperaturen.
Wie schon beschrieben, müssen der farbigen Struktur des Farbstoffs die Protonen entzogen werden. Dies geschieht nur in einem ganz bestimmten Reaktionsmedium.
Hier kommt nun die dritte Komponente (Komponente C) der Tinte ins Spiel. Laut Angaben in den Patentschriften [4] handelt es sich meist um Ester, Ketone, Alkohole oder Säureamide mit einem Schmelzpunkt zwischen 5-50 °C.
Hier ein Beispiel für einen langkettigen Ester.
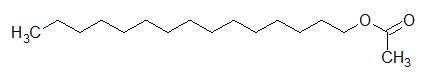
Struktur von Essigsäurepentadecylester
Die Stoffe haben einen stoffspezifischen Schmelzpunkt. Da sie aber als Gemisch aus den drei Komponenten A-C vorliegen, ergibt sich ein Schmelzbereich für jede Tinte eines Farbstiftes. Die Hersteller können also durch Wahl des Reaktionsmediums festlegen, in welchem Temperaturbereich der Protonenaustausch und damit die Entfärbung stattfindet.
Für den normalen Gebrauch der Farbstifte sollte die Entfärbung nicht unter 50 °C stattfinden, sonst würde die Farbe an heißen Sommertagen schon im Stift farblos vorliegen. Andererseits sollte die Entfärbungstemperatur nicht höher als 70 °C liegen, da diese Temperatur durch Reibung mit dem mitgelieferten Reibegummi leicht erzeugt werden kann. Auf diese Weise kann man Schreib- und Malfehler leicht entfernen.
Sind die Schreib- und Malfehler wirklich weg?
Wie kann man die Farben wieder zum Leben erwecken?
Die Hersteller der Stifte empfehlen bei einer Entfärbung eine Lagerung im Gefrierfach bei Temperaturen unter -10 °C.
Kühlt man die „Bunte Chemie“ für einen Zeitraum von einer Stunde im Gefrierfach bei -18 °C, so kommen die Farben wieder zum Vorschein und erstrahlen in gleicher Brillanz wie vor dem Erhitzen im Laminator oder in der heißen Sommerhitze.
Bild 8: Bunte Chemie gekühlt
(Foto: Schorn)
Nun fragt man sich, wieso erscheinen die Farben nicht schon beim Abkühlen auf Raumtemperatur?
Hierzu muss man beachten, dass die Tinten in zwei Systemzuständen vorkommen können. In der farblosen Form und in der farbigen Form.
Die Umwandlung zur farblosen Form verläuft als endotherme Reaktion, die je nach Tinte bei unterschiedlich hohen Temperaturen auftritt. Bei der schwarzen Tinte findet dies bei der Temperatur zwischen 57-60 °C statt [5]. Schwarzer Tinte muss also eine ganz bestimmte Energie (Aktivierung) in Form von Wärme zugeführt werden, damit sie den farblosen Zustand annimmt.
Die Umwandlung zur farbigen Form verläuft als exotherme Reaktion zwischen -3 - 0 °C ab. Farblose Tinte wandelt sich erst bei dieser Temperatur wieder in den farbigen Zustand um.
Zwischen beiden Zuständen der Tinte befindet sich eine Aktivierungsbarriere, die hoch genug ist, sodass beide Formen (farblose und farbige Tinte) bei Raumtemperatur für lange Zeit nebeneinander existieren können. Es hängt von der „Vorgeschichte“ der Tinte ab, welchen Zustand die Tinte bei Raumtemperatur einnimmt. Solche Phänomene nennt man Hysterese und man kann dies mit dem Wort „Nachwirkung“ übersetzen. Der Prozess der vorher stattgefunden hat (Entfärbung oder Einfärbung) wirkt auf den Zustandswechsel der Tinte nach.
Vergleichbare Phänomene gibt es auch in der Physiologie bei sogenannten thermischen Hystereseproteinen. Diese Proteine verhindern die Eisbildung in Körperflüssigkeiten bei Tieren oder Pflanzen und dienen somit als Gefrierschutz. Die betreffenden Körperflüssigkeiten gefrieren bei -5 °C, tauen aber erst bei 0 °C wieder auf [6].
Also, keine Angst. Die schönen Farben zur Verschönerung des Chemieraums sind nicht verschwunden, sondern nur kurzzeitig in einen anderen Zustand gewechselt. Ab damit ins Gefrierfach und die „Bunte Chemie“ ist wieder da.
Quellen:
[1] E. Harnik and G. M. J. Schmidt, The structure of overcrowded aromatic compounds. Part II. The crystal structure of dianthronylidene, J. Chem. Soc., 1954, 3295-3302, London
[2] J. F. D. Mills, S. C. Nyburg, 49. Thermochromism and related effects in bixanthenylidenes and bianthronylidenes. Part I. Crystal structure analyses, J. Chem. Soc., 1963, 308-321
[3] https://www.pinterest.de/x3736/thermochromic/ (abgerufen am 12.05.2017)
[4] http://www.freepatentsonline.com/4028118.pdf (abgerufen am 12.05.2017)
[5] Dean J. Campbell, Wayne A. Bosma, Stephen J. Bannon, Molly M. Gunter, and Margaret K. Hammar; Demonstration of Thermodynamics and Kinetics Using FriXion Erasable Pens; J. Chem. Educ., 2012, 89 (4), pp 526–528, Washington, D.C.
[6] https://de.wikipedia.org/wiki/Hysterese (abgerufen am 23.06.2017)
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 4. Juli 2017, Fritz Meiners





