Prof. Blumes Tipp des Monats November 2006 (Tipp-Nr. 113)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Bunte Chemie mit meinem Lieblingsindikator Thymolblau
Thymolblau ist ein Säure/Base-Indikator mit zwei Umschlagsbereichen. Deshalb zeigt er auch drei verschiedene Farben: Rot, Gelb und Blau. Leider ist er recht wenig bekannt. Das liegt auch daran, dass seine Lösung nicht lange haltbar ist. Aber man kann mit ihm wunderschöne chemische Experimente machen.
|
Versuch 1: Herstellen einer Thymolblaulösung
Ergebnis:
|
Hiermit können wir die Indikatorwirkung von Thymolblau untersuchen.
|
Versuch 2: Farben des Thymolblausystems
Ergebnis:
|

Bild 1: Die drei Farben von Thymolblau
(Foto: Blume)
Besonders gut geeignet sind die Indikatorreaktionen von Thymolblau auch für eine Bunte
Reihe.
|
Versuch 3: Eine Bunte Reihe mit Thymolblau
Hier sind die Angaben für 250 ml Startlösung:
Gießen Sie nun den Inhalt von Glas 1 ins zweite, die so entstandene Mischung ins dritte und die daraus resultierende Mischung ins vierte Glas. Ergebnis:
|
Aber auch andere Tricks gelingen damit. So können wir zeigen, dass das Zusammenrühren von Rot und Blau nicht Lila ergeben muss - wie es die Schüler erwarten, weil sie es so vom Farbmischen aus dem Kunstunterricht oder von der Farbenlehre her kennen.
|
Versuch 4: Ungewöhnliche Farbmischung
Ergebnis
|
 |
| Bild 2 (Foto: Daggi)
Hierzu gibt es einen Film (3,6 MB) Klicke hier |
Was steckt chemisch dahinter? Die Antwort lautet schlicht: Eine bekannte Neutralisationsreaktion. Hier
ist die Reaktionsgleichung mit den Indikatorfarben:
NaOH (blau) + HCl (rot) ———> NaCl (gelb) + H2O
Zum Indikatorverhalten von Thymolblau
Thymolblau zeigt drei Farben und hat damit zwei Umschlagbereiche.
| Rot | ———> Gelb | pH 1,2-2,8 |
| Gelb | ———> Blau | pH 8,0-9,6 |
Diese Bereiche können wir sehr gut mit der bekannten pH-Reihe, die wir auch beim Rotkohlsaft oder bei den anderen Anthocyanen verwenden, zeigen.
|
Versuch 5: pH-Reihe von Thymolblau
|

Bild 3: pH-Reihe von Thymolblau
(Foto: Daggi)
Thymolblau ist übrigens nicht identisch mit dem vom pH-Papier her bekannten Universalindikator. Bei
dem handelt es sich um eine Mischung verschiedener Indikatorsubstanzen.
Erklärung des Farbverhaltens
Hier sind die Formeln der Strukturen des Thymolblau-Moleküls, die in den verschiedenen pH-Bereichen vorherrschen.
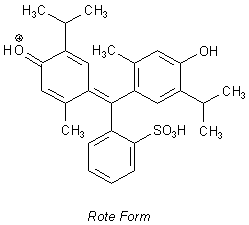
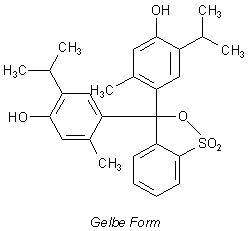
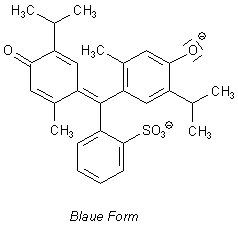
Strukturformeln von Thymolblau
Kann man aus den beobachteten Farben auf die Strukturen schließen?
Das kann man durchaus. Denn wenn ein Stoff eine bestimmte Farbe zeigt, absorbiert er dessen Komplementärfarbe.
Ist er zum Beispiel rot, so absorbiert er Blaugrün (Cyan).
| pH-Bereich | Farbe | Absorbierte Farbe | Absorptionsmaximum |
| Stark sauer | Rot | Cyan | bei 520 nm |
| Schwach sauer bis neutral | Gelb | Blau-Violett | < 440 nm |
| Alkalisch | Blau | Gelborange | bei 580 nm |
Man muss sich also nicht etwa über die Strahlungsenergie der nach außen hin sichtbaren Farbe Gedanken machen, sondern über die Strahlungsenergie des absorbierten Lichtanteils. Diese Energie ist nach Max Plancks berühmter Formel umgekehrt proportional zur Wellenlänge:

Man kann durchaus anhand der chemischen Strukturen erklären, wie die drei Farben des Thymolblaus zustande kommen.
Grundsätzlich beruht die Absorption von elektromagnetischer Strahlung auf der Wechselwirkung mit Elektronen des Moleküls. (Die Verbreiterung der Bande durch Absorption von Energie, die Molekülschwingungen anregt, lassen wir mal weg.)
Gleich vorneweg: Im Molekül sind an der Farbgebung nicht nur die beiden oberen Ringe des Thymolblaus beteiligt. Auch die Sultongruppe ist mit einbezogen.
| - | Im sauren Milieu ist die Sulfonsäuregruppe protoniert.
Der Sultonring kann sich deshalb nicht schließen; es resultiert eine chinoide Struktur. Sie ist wegen der sp2-Hybridisierung
des zentralen C-Atoms planar. Das Molekül zeigt deshalb eine Reihe von mesomeren Grenzstrukturen, bei denen es vor allem
um den Ausgleich der positiven Ladung geht.
|
| - | Bei pH-Werten um den neutralen Bereich herum schließt sich der esterartige Sultonring spontan. Das Molekül ist nicht mehr planar. Die Mesomerie ist unterbrochen. Man sollte den Totalverlust der Farbigkeit erwarten. Wegen der stark elektronenschiebenden aliphatischen Substituenten an den beiden Ringen und wegen der Einbeziehung des Sultonrings resultiert jedoch eine gelbe Färbung. Diese Mesomerie umfasst die Gruppenreihe (H)O-Phenyl-Sulton - und das für zwei Benzolringe. Das geschieht trotz des Mesomerie-hindernden sp3-hybridisierten zentralen C-Atoms. Weil die Anregung dieser Mesomerie eine hohe Energie erfordert, wird dazu Blau-Violett absorbiert. Das ist für die Gelbfärbung „verantwortlich“. |
| - | Im alkalischen Milieu haben wir ein Elektronenüberschuss-System vorliegen, das besonders leicht anregbar ist. Deshalb beobachten wir eine intensive Blaufärbung mit niedriger Anregungsenergie. |
Die anderen zu erkennenden Farben sind Farbmischungen.
Thymolblau ähnelt dem Phenolphthalein
Zunächst einmal sind beide Substanzen phenolische Triphenylmethanfarbstoffe. Bei letzterem handelt
es sich um eine Carbonsäure bzw. um deren inneren Ester (Lacton). Beim Thymolblau liegt dagegen eine
Sulfonsäure mit ihrem inneren Ester (Sulton) vor. (Thymolblau wird chemisch auch als Thymol-sulfo-phthalein
bezeichnet.) Vergleichen Sie selbst: Hier sind die entsprechenden Strukturen des Phenolphthaleins.
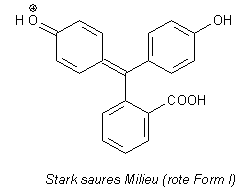
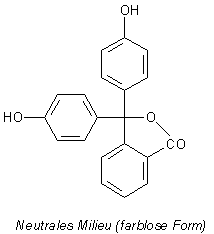
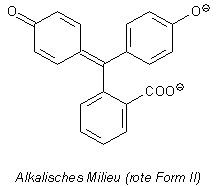
Strukturformeln von Phenolphthalein
Bleibt die Frage: Wenn der Vergleich so offensichtlich richtig ist - was ist dann die dritte Farbstufe
von Phenolphthalein? Diese gibt es tatsächlich - aber allerdings nur in sehr stark saurem Milieu. Das
erkennen Sie schon, wenn Sie Phenolphthalein herstellen - das
geschieht in einer schwefelsäurehaltigen Schmelze. Da entsteht zunächst ein roter Farbstoff, der erst,
wenn er ins Wasser gegossen wird, farblos wird. Die Farblosigkeit ergibt sich aus den fehlenden aliphatischen
Substituenten.
Dass sich dagegen die Protonierung beim Thymolblau schon bei so hohen pH-Werten wie 1,2-2,8 (das heißt bei vergleichsweise niedrigen Säurekonzentrationen) und nicht erst in schwefelsaurer Schmelze bemerkbar macht, liegt an den starken (+I)-Effekten der aliphatischen Substituenten an den Benzolringen des Moleküls. Die schieben kräftig Elektronen in den Ring, wodurch die Sauerstoffsubstituenten stärker basisch und deshalb leichter protonierbar werden.
Warum zeigt Phenolphthalein im Neutralen anders als Thymolblau keine gelbe Färbung? Sein Lactonring beeinflusst im Gegensatz zum Sultonring die Mesomerie nicht. Deshalb ist Phenolphthalein im neutralen Bereich farblos.
Bromiertes Thymolblau - Der Indikator Bromthymolblau
Die gleiche Diskussion wie beim Thymolblau gilt auch für das Bromthymolblau, von dem es (anders als man so liest)
ebenfalls eine rote Form gibt. Nur bildet sich diese Form erst im stark sauren Bereich, also unterhalb pH 0. Damit ist
Bromthymolblau (genauso wie Phenolphthalein) nicht als Titrationsindikator im sauren Milieu geeignet.
Woran liegt es, dass die Moleküle von Bromthymolblau erst im stark Sauren protoniert werden und die Lösung somit rot wird?
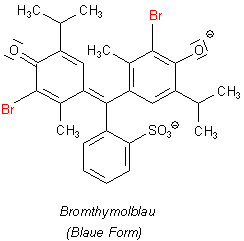
Die Bromatome zeigen einen starken -I-Effekt, das heißt, dass sie Elektronen aus den Benzolringen abziehen. Damit werden auch die nichtbindenden Elektronenpaare der phenolischen Hydroxylgruppen in Richtung auf die aromatischen Kerne gezogen. Um dennoch deren Protonierung zu erreichen, muss der Protonendruck deutlich stärker sein als beim Thymolblau. Somit beobachtet man die Rotfärbung von Bromthymolblau wie beim Phenolphthalein erst weit unterhalb von pH 0, also in 65%iger Perchlorsäure oder Schwefelsäure.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 10. Juni 2010, Dagmar Wiechoczek