Prof. Blumes Bildungsserver für Chemie
Tipp des Monats August 2017 (Tipp-Nr. 242)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Säureunfall in Oberhausen – ein tragischer Fehler
Uwe Lüttgens
Am 16. Februar 2017 kam es in einem Chemie-Unternehmen in Oberhausen zu einem Zwischenfall. Im Hafen leiteten Arbeiter versehentlich beim Entladen eines Schiffes Salzsäure in einen 3000 Tonnen fassenden Tank, der bereits mit Schwefelsäure befüllt war. Gott sei Dank, so heißt es später, seien keine Menschen verletzt worden, als eine „Rauchwolke“ entstanden“ sei – nachzulesen auf der Homepage der Westdeutsche Allgemeine Zeitung (WAZ) [1]. Die Feuerwehr musste aber eine Warnung vor dem entweichenden „Giftgas“ an die umliegende Bevölkerung ausgeben, damit sie in ihren Häusern bleiben und die Fenster geschlossen halten, weil aus dem mit ca. 300 bis 400 Tonnen Schwefelsäure befüllten Tank durch das Einleiten der Salzsäure eine „Säurewolke“ ausgetreten und über das Chemiewerk gezogen sei. Auch die Autofahrer auf den anliegenden Straßen und der Autobahn, die direkt am Chemiewerk vorbeiführt, mussten Geduld mitbringen. Sie wurden ebenso gesperrt, wie die Bahnstrecke zwischen Oberhausen und Wesel, Der Nachrichtensender WELT N24 berichtet, dass „vorsorglich 40 Beschäftigte des Betriebes und weitere 110 Mitarbeiter angrenzender Wirtschaftsbetriebe untersucht wurden.“ [2] Im Bericht der Nachrichten auf Heute.de wird es konkreter: „Giftige Dämpfe steigen auf. Mindestens ein Tank ist leckgeschlagen, 96%ige Schwefelsäure lief aus und verdampfte zum Teil.“ Von einer „stark ätzenden Wolke“ ist die Rede. [3] Wichtiger Hinweis: Der Versuch zur „Reaktion von konzentrierter Salzsäure mit konzentrierter Schwefelsäure“ bleibt nur erfahrenen Experimentatoren vorbehalten! Im Labor haben wir den Versuch in einem größeren Demonstrations-Reagenzglas durchgeführt. Klick mich an! Bild 1: Reaktion von konz. Schwefelsäure mit konz. Salzsäure
Es beginnt erkennbar zu sprudeln – Zeichen einer Gasentwicklung – gleichzeitig steigt die Temperatur rasch von 20 °C auf über 40 °C an. Die Freisetzung von Wärme deutet auf eine exotherme Reaktion hin. Eine „Wolke“ entweicht erkennbar aus dem Reagenzglas.
Im Datenblatt zu Chlorwasserstoff [6] findet sich für Salzsäure der Hinweis: Farbloses, giftiges, sehr hygroskopisches, verflüssigtes Gas mit stechendem Geruch. Starke Reizwirkung auf Augen, Haut und Schleimhäute. An feuchter Luft bildet HCl-Gas Nebel aus feinen Salzsäuretröpfchen. In der 102. Auflage des „Holleman-Wiberg“ (HoWi), wohl auch heute noch eine der Bibeln fast jedes Chemiestudenten, heißt es dazu: „Die Neigung von HCl, sich mit H2O zu verbinden, ist so groß, dass HCl-Gas an feuchter Luft raucht (Bildung von Nebel aus HCl-haltigen H2O-Tröpfchen).“ [7] Chemikerinnen und Chemiker sprechen auch von rauchender Salzsäure. Klick mich an! Bild 2: Rauchende Salzsäure
Hinweis: In einem früheren Tipp haben wir uns mit der Stärke der Salzsäure und der Schwefelsäure auseinandergesetzt. In der Chemie wird bei solchen Mischungen von Azeotropen gesprochen. Bekanntes Bespiel ist mit Wasser verdünnter Alkohol. Bei einem Ethanolgehalt von 96,5 Vol% hat der Dampf die gleiche Zusammensetzung wie die Flüssigkeit. Folglich kann das azeotrope Gemisch durch Erhitzen nicht weiter getrennt werden. Weitere Informationen zu azeotropen Gemischen finden sich hier, erläutert am Beispiel der Trennung einer Mischung von Wasser und Alkohol. Zurück zur Salzsäure. Konzentrierte Salzsäure (20,22 Gew% HCl) bildet mit Wasser ebenfalls ein Azeotrop. Das Gemisch aus Chlorwasserstoffgas und Wasser siedet bereits bei 108,5 °C, also knapp über dem Siedepunkt von Wasser und damit bei einer um 230 °C geringeren Temperatur im Vergleich zur Siedetemperatur von konzentrierter Schwefelsäure. Die Schwefelsäure wird also kaum aus dem Tank verdampft sein. Tatsächlich haben die Hydrate eine salzartige Struktur, bei der ein Sulfat-Ion von einer komplexen Struktur aus Hydronium-Ionen und Wassermolekülen umgeben ist. In Ionenschreibweise könnte ein mit - beispielsweise 8 Wassermolekülen gebildetes Hydrat der Schwefelsäure als [H9O4]2[SO4] formuliert werden. Die exotherme Reaktion macht die Sache so gefährlich. Im Chemieunterricht lernen wir bereits, dass äußerste Vorsicht beim Verdünnen von starken Säuren angebracht ist! Wer Genaueres über die Reaktion von konzentrierter Schwefelsäure mit Wasser sucht, findet hier einen Tipp mit Versuchen. In der Oberhausener Firma wurde versehentlich die konzentrierte Schwefelsäure mit der konzentrierten Salzsäure verdünnt. Die beim Verdünnen der Schwefelsäure freigesetzte Wärme heizte den Tank mit dem Säuregemisch auf. Übrigens: Bei diesem Lösevorgang handelt es sich nicht um einen rein physikalischen Vorgang, sondern um eine chemische Reaktion. Chlorwasserstoff dissoziiert in Wasser vollständig unter Bildung von Hydronium-Ionen und Chlorid-Ionen. Die Säure-Base-Reaktion kann entsprechend formuliert werden: Wir wissen: Bei höheren Temperaturen nimmt die Löslichkeit von Gasen in wäßrigen Lösungen ab - in diesem Fall die des Chlorwasserstoffs. Bei 0 °C lösen sich 823 g Chlorwasserstoff, also mehr als 22 mol in 1 l Wasser (Molmasse M(HCl) = 36,46 g/mol). Das heißt: Mehr als 500 l HCl-Gas befinden sich in einem Liter konzentrierter Salzsäure [7]. Bei Raumtemperatur, also 20 °C, sind es bereits nur noch 720 g des gefährlichen Gases. Und die Löslichkeit sinkt mit steigender Temperatur weiter. Erreicht die Lösung eine Temperatur von 60 °C, dann sind es nur noch 561 g gelöstes Chlorwasserstoffgas in einem Liter. [9] Prozentual ausgedrückt: Erhitzt man Salzsäure von Raumtemperatur auf 60 °C, werden 22 % des in der Lösung enthalten Chlorwasserstoffgases freigesetzt. Theoretisch wird das Gas solange freigesetzt, bis der Siedepunkt des Azeotrops erreicht ist und die Zusammensetzung der flüssigen Salzsäure und des darüber befindlichen Dampfes gleich sind. Anschließend verdampft ein azeotropes Gemisch aus Chlorwasserstoffgas und Wasserdampf. Demzufolge bestand die Wolke, die bei dem Unfall freigesetzt wurde, aus Wassertröpfchen, in denen Chlorwasserstoff gelöst ist. Eine ätzende „Säurewolke“, die wir bei unserem Versuch Gott sei Dank nur im Reagenzglas bewundern dürfen.
Was tatsächlich geschah!
Schauen wir an, was eigentlich passiert, wenn die beiden konzentrierten Säuren miteinander in Berührung kommen. Hierzu haben wir einen Lehrerversuch.
(Foto: Lüttgens)
„Rauch“, „Wolke“ oder „Dampf“ – was steigt denn nun auf?
Klären wir zunächst einmal die Begriffe. Unter einer Wolke verstehen wir ebenso wie unter einem Nebel oder einem Dampf zunächst mal etwas Feuchtes und Nasses – wie wohl der aus dem Indogermanischen stammende Begriff uelg besagt [4a]. Es gibt Regenwolken und in der oberen Atmosphäre auch Eiswolken. Der Deutsche Wetterdienst spricht in seinem Glossar bei einer Wolke daher von einer „Ausscheidung atmosphärischen Wasserdampfs in flüssiger und fester Form“, einem sogenannten Hydrometeor [4b], der durch Kondensieren von gasförmigem Wasser zu flüssigem Wasser oder auch durch Sublimieren des gasförmigen Wassers zu Eiskristallen entstehen kann. Aber Rauch?
Bei Rauch handelt es sich, wie der Blick ins Chemiebuch [5] offenbart, um fein verteilte feste Partikel in einem Gas. Nun kondensiert Wasser in feuchter Luft meist erst zu Wassertröpfchen, wenn es dafür geeignete feste Keime gibt. Das können sehr kleine Staubkörnchen oder andere Partikel wie z.B. Ruß sein, die Wasserdampf aus der Umgebungsluft an sich binden können – sie sind also hygroskopisch (griech. hygrós: feucht, skopéo: schaue). Die Kondensationskeime wachsen an und bilden schließlich im Vergleich zur anfänglichen Partikelgröße riesige Wassertropfen, die bekanntlich aus den Wolken abregnen können, wenn die Schwerkraft überhandnimmt. Da trotz der festen Kondensationskeime eine Wolke dann doch überwiegend aus Wasser besteht, ist die „Rauchwolke“ wohl eher eine „vernebelte“ Wortkreation eines Nachrichtenredakteurs gewesen. Oder vielleicht doch nicht?
Einige Informationen zu den beiden ätzenden Säuren.
Bei konzentrierter Schwefelsäure H2SO4 handelt es sich um eine ölige Flüssigkeit, in der kaum Wasser enthalten ist. Sie hat eine Konzentration von 96-98 %. Konzentrierte Salzsäure ist eine wässrige Lösung des Gases Chlorwasserstoff HCl. Das Gas löst sich jedoch nur bis zu einer Konzentration von ca. 37-38 %.
Also kann ein feiner Nebel einer ätzenden Säure offensichtlich doch Rauch entwickeln?!
(Foto: Lüttgens)
Für Spezialisten: Kann die 96%ige Schwefelsäure aus dem Tank verdampfen, wenn versehentlich konzentrierte Salzsäure zugegeben wird?
Wohl kaum, wie wir den Informationen im „HoWi“ [7,8] entnehmen können: Bei einem konstanten Siedepunkt von 338 °C bildet eine 98,33%ige Schwefelsäure ein Gemisch mit Wasser, das sich durch Destillieren nicht weiter in seine beiden Bestandteile – die reine 100%ige Schwefelsäure und Wasser - trennen lässt.
Für Spezialisten: Die Hintergründe zum Experiment
Gelangt konzentrierte 37%ige Salzsäure, die ja überwiegend aus Wasser besteht, in ein Gefäß mit 96%iger Schwefelsäure, findet eine exotherme Reaktion der Schwefelsäure mit dem Wasser statt. Schwefelsäuremoleküle umgeben sich dabei mit mehreren Wassermolekülen. Diese so gebildeten Hydrate können folgendermaßen formuliert werden: H2SO4 • H2O. Die vereinfachte Reaktionsgleichung lautet: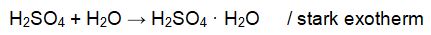
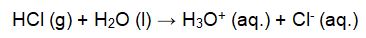
Quellen:
[1] https://www.waz.de/staedte/oberhausen/saeurewolke-in-oberhausen-mitarbeiter-machten-fehler-beim-entladen-id209627397.html (abgerufen am 20.4.2017)
[2] https://www.welt.de/newsticker/dpa_nt/infoline_nt/brennpunkte_nt/article162118628/Saeurewolke-zieht-nach-Chemieunfall-ueber-Oberhausen.html (abgerufen am 20.4.2017)
[3] http://www.heute.de/behoerden-in-oberhausen-warnen-vor-schadstoffwolke-46563032.html (abgerufen am 12.6.2017)
[4a] https://de.wikipedia.org/wiki/Wolke (abgerufen am 12.62017)
[4b] https://www.dwd.de/DE/service/lexikon/Functions/glossar.html?lv2=102936&lv3=103238 (abgerufen am 12.6.2017)
[5] FOKUS Chemie, Gesamtband Ausgabe A, Cornelsen Schulverlage 2015, S. 41
[6] http://www.messer.ch/produkte_loesungen/gasedaten/physdatenbl/Chlorwasserstoff_phys_d.pdf (abgerufen am 20.4.2017)
[7] A.F.Holleman, E.Wiberg, N.Wiberg, Walter de Gruyter, Berlin 2007, S. 453
[8] A.F.Holleman, E.Wiberg, N.Wiberg, Walter de Gruyter, Berlin 2007, S. 586
[9] GESTIS-Stoffdatenbank zu Chlorwasserstoff, http://gestis.itrust.de/nxt/gateway.dll/gestis_de/001050.xml?f=templates$fn=default-doc.htm (abgerufen am 19.6.2017)
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 26. Juli 2017, Fritz Meiners

