Prof. Blumes Bildungsserver für Chemie
Tipp des Monats Juni 2019 (Tipp-Nr. 264)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Von der Kunst einen Wasserkocher zu entkalken
Sabine Streller
Immer wieder finden sich den Medien Hinweise, dass man eine Mischung von Wasser und Citronensäure zum Entkalken von Haushaltsgeräten nicht zu stark erhitzen soll: „Zitronensäure dürfen Sie ausschließlich für sogenannte Kaltentkalkungen verwenden – das Wasser darf nicht wärmer als 40 Grad sein. Die Säure ist nicht hitzebeständig und wird bei hohen Temperaturen zu Calciumcitrat. Die Ablagerungen, die diese chemische Verbindung produziert, setzen sich im Wasserkocher so fest, dass sie nur noch sehr schwer zu entfernen sind.“ [1] Schaut man dagegen auf die Anleitung eines Herstellers, wie Citronensäure zum Entkalken eingesetzt werden soll, sehen wir, dass sehr wohl kräftig erhitzt werden soll (Bild 1, rechts). Ja was denn nun? Klick mich an! Bild 1: Wasserkocher mit Kalkablagerungen (links), Anleitung zum Entkalken auf der Verpackung eines Herstellers (rechts)
Bei sogenanntem harten Wasser ist der Gehalt an Calcium-Ionen höher als bei sogenanntem weichen Wasser. Die Wasserhärte wird neben den Calcium-Ionen auch von Magnesium-Ionen verursacht und als Carbonathärte bestimmt. Die Begriffe hart und weich rühren von dem Gefühl her, dass das Wasser beim Waschen mit Seife vermittelt [2]. Mit hartem Wasser bilden die Fettsäureanionen der Seifen mit den Calcium-Ionen schwerlösliche Kalkseife, die als trübe Ausfällung sichtbar wird. Versuch 1: Bestimmung der Wasserhärte Bild 2: Entionisiertes Wasser (RG 1) und Berliner Trinkwasser (RG 2) mit Kernseife versetzt (links), Wasserhärtebestimmung von Berliner Trinkwasser (rechts)
(Foto: Streller)
Wie entstehen Kalkablagerungen?
Im Trinkwasser sind verschiedene Mineralien gelöst. Deshalb enthält es unter anderem Calcium-Ionen und Carbonat-Ionen. Beim örtlichen Wasserwerk kann man sich nach der Zusammensetzung des Trinkwassers erkundigen. In kohlensäurehaltigem Wasser ist Kalk gut löslich. Wird das Wasser aber erhitzt, verschiebt sich das Gleichgewicht zwischen Calciumcarbonat und Calciumhydrogencarbonat nach links, Kohlenstoffdioxid entweicht und Kalk fällt aus.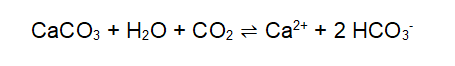
Ergebnis: In RG 1 mit entionisiertem Wasser ist die Lösung klar und eine starke Schaumbildung sichtbar. Im RG 2 ist die Lösung trüb und Schaum ist nicht entstanden. Die Wasserprobe muss eine hohe Wasserhärte aufweisen.
Ergebnis: Das untersuchte Wasser aus Berlin besitzt eine Wasserhärte von ca. 17°dH (Grad deutscher Härte).
(Foto: Streller)
Wie funktioniert Entkalken mit Citronensäure?
Citronensäure ist eine geruchlose Tricarbonsäure, die sehr gut in Wasser löslich ist (ca. 880 g/L bei 20 °C [3]). Sie reagiert kräftig mit Calciumcarbonat, was am starken Sprudeln gut zu erkennen ist. Mit dem sichtbaren Sprudeln wird Kohlenstoffdioxid aus dem Carbonat freigesetzt. In der Lösung liegen nun also Citrat-Ionen und Calcium-Ionen vor, die als schwerlösliches Calciumcitrat ausfallen:
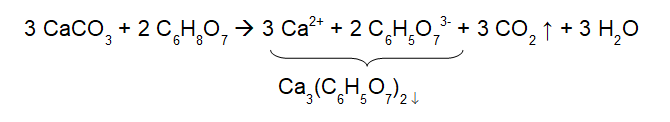
Die Löslichkeit von Calciumcitrat in Wasser ist sehr gering, sie beträgt nur 0,96 g/L bei 23 °C [4]. Um diese Fällung von Calciumcitrat nachzuweisen, bringen wir stöchiometrisch äquivalente Mengen von Calciumcarbonat (M = 100 g/mol) und wasserfreie Citronensäure (M = 192 g/mol) zur Reaktion. 3 mol Calciumcarbonat entsprechen 300 g, 2 mol Citronensäure 384 g. Bei einem millimolaren Ansatz – wir müssen nur durch 1000 teilen - erhalten wir ca. 0,3 g und 0,38 g, die wir einsetzen können. Da bei dieser Reaktion 1 mol Calciumcitrat entsteht (M = 498 g/mol (wasserfrei) bzw. M = 570 g/mol (Tetrahydrat)) sollten wir die Löslichkeitsgrenze deutlich überschreiten – Calciumcitrat also ausfallen –, wenn wir in einer Größenordnung von 50 – 100 mL Lösung arbeiten.
|
Versuch 2: Reaktion von Calciumcarbonat mit Citronensäure Geräte: zwei Bechergläser (100 mL), Reagenzgläser, Wasserbad, Citronensäure, Calciumcarbonat 0,3 g Calciumcarbonat werden eingewogen und in 50 mL Wasser aufgeschlämmt. In das zweite Becherglas werden 0,38 g Citronensäure eingewogen und in 50 mL Wasser gelöst. Je 3 mL beider Lösungen werden in einem Reagenzglas gemischt und in ein heißes Wasserbad gestellt. Ergebnis: Nach heftigem Sprudeln entsteht kurzzeitig eine klare Lösung, die sich erneut trübt. Nach einer Stunde ruhigem Stehen entstehen flockige Kristalle.
Bild 3: Ausfällung von Calciumcitrat
|
Für Spezialisten:
Calciumcitrat ist ein besonders Salz. Es löst sich in heißem Wasser schwerer als in kaltem. Man spricht in solchen Fällen von einer inversen Löslichkeit. Das Salz bildet in Wasser in einer exothermen Reaktion einen Komplex, das Calciumcitrat-Tetrahydrat. Dessen Löslichkeit verläuft schwach endotherm, die zu dieser „umgekehrten“ Löslichkeit führt [5].
Wer wie ich in einem Gebiet mit hartem Wasser wohnt, muss öfter mal zum Entkalker greifen. Ich nutze seit Jahren Citronensäure und bin noch nie von solchen Ablagerungen überrascht worden. Aber warum? Schauen wir nochmals auf die Anleitung des Herstellers: Hier wird empfohlen einen Wasserkocher mit 2 Esslöffeln Citronensäure zu entkalken. Ermitteln wir also die Mengenangaben der eingesetzten Citronensäure: zwei Esslöffel entsprechen ca. 30 g. Und wieviel Kalk befindet sich in einem Wasserkocher? Wir haben einen alten, mit Kalk verkrusteten Wasserkocher gefunden und den Kalk herausgekratzt. Alle Verluste, die beim Kratzen durch wegspritzende Kalksplitter entstanden sind, wieder addiert, enthielt der Wasserkocher 2 g Kalk. Bringen wir also Calciumcarbonat und Citronensäure erneut zur Reaktion – diesmal aber im stöchiometrischen Verhältnis von ca. 1 : 7.
|
Versuch 3: Reaktion von Calciumcarbonat mit einem Überschuss Citronensäure Geräte: zwei Bechergläser (100 mL), Reagenzgläser, Wasserbad, Citronensäure, Calciumcarbonat 0,3 g Calciumcarbonat werden eingewogen und in 50 mL Wasser aufgeschlämmt. In das zweite Becherglas werden 4,5 g Citronensäure eingewogen und in 50 mL Wasser gelöst. Je 3 mL beider Lösungen werden in einem Reagenzglas gemischt und in ein heißes Wasserbad gestellt. Ergebnis: Nach heftigem Sprudeln entsteht eine klare Lösung. Auch nach Stunden ist die Lösung klar. |
Was ist passiert? Calciumcitrat ist zwar sehr schlecht in Wasser löslich, jedoch gut in verdünnter Citronensäure-Lösung (und auch in anderen verdünnten Säuren). Auch die Ausfällung von Calciumcitrat aus Versuch 2 lässt sich in Citronensäure lösen: einfach eine Spatelspitze Citronensäure in das Reagenzglas zur Ausfällung geben, kurz erhitzen und das Calciumcitrat löst sich.
Wird Citronensäure in der Hitze zerstört?
Im Eingangszitat wird als Begründung für die Kaltentkalkung mit Citronensäure angeführt, dass die Säure nicht hitzestabil sei. Diese Behauptung prüfen wir mit einem einfachen Versuch.
|
Versuch 4: Untersuchung der Hitzestabilität von Citronensäure Geräte: zwei Reagenzgläser, Reagenzglasklammer, Gasbrenner, Pipette (oder Bürette), Citronensäurelösung (ω = 10 % [d.h. 10 g Citronensäure + 90 g Wasser]), Natronlauge (ω = 10 %), Universalindikator In die Reagenzgläser werden je 5 ml Citronensäure-Lösung gegeben. Ein Reagenzglas wird vorsichtig in der Brennerflamme für drei Minuten erhitzt. Nach dem Abkühlen werden beide Lösungen einige Tropfen Universalindikator gegeben und bis zum Umschlagspunkt mit Natronlauge versetzt. Die Menge der benötigten Natronlauge wird ermittelt (im Handversuch mit der Pipette oder genauer mit einer Bürette). Ergebnis: Die benötigte Menge Natronlauge ist gleich. |
Tatsächlich liegt die Zersetzungstemperatur von Citronensäure oberhalb von 170 °C [3].
Fazit: Wer hat Recht?
Beide. Ja, bei der Verwendung von Citronensäure als Entkalker kann Calciumcitrat ausfallen und so hartnäckige Ablagerungen verursachen. Und ja, Citronensäure ist auch zum Heißentkalken anwendbar! Aber eben nur unter bestimmten Bedingungen. Wird Citronensäure sparsam verwendet, kann sich schwerlösliches Calciumcitrat bilden, wird die Citronensäure aber im Überschuss verwendet, wie den Herstellerangaben zu entnehmen ist, dann ist sie auch heiß ein prima Entkalker.
Literatur:
[1] https://www.t-online.de/heim-garten/haushaltstipps/id_73418522/wasserkocher-entkalken-mit-zitronensaeure-und-anderen-hausmitteln-kein-problem.html (abgerufen am 3.5.2019, 9:20)
[2] A. F. Holleman, E. Wiberg: Lehrbuch der Anorganischen Chemie, Walter de Gruyter, Berlin, New York, 1995, 101. Auflage, S. 1138.
[3] Sicherheitsdatenblatt Merck Citronensäure http://www.merckmillipore.com/DE/de/product/msds/MDA_CHEM-100247?Origin=PDP (abgerufen am 3.5.2019, 9:37)
[4] Sicherheitsdatenblatt Merck tri-Calciumdicitrat-
[5] M. Vavrusova, L.H. Skibsted (2016), International Dairy Journal, 57, S. 20-28 https://www.sciencedirect.com/science/article/abs/pii/S0958694616300425 (abgerufen am 14.5.2019, 7:40)
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 23. Mai 2019, Fritz Meiners

