Prof. Blumes Bildungsserver für Chemie
Tipp des Monats Juli 2023 (Tipp-Nr. 313)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Uwe Lüttgens
Der Sommer kommt, der Sommer geht. Mit dem Ende der Ferien verwirren sich hitzebedingt schon einmal die Gedanken und Erinnerungen. Und häufiger auch das Wissen um die Chemie: Vieles, was uns noch vor Wochen zweifelhaft und unsinnig erschien, scheint nun irgendwie richtig und nachvollziehbar zu sein. Bild 1: Heiße Sommer sind am Meeresstrand gut erträglich.
Ein Beispiel, häufig in Freibädern und an den Ufern von Badegewässern zu sehen: Getränke werden eiskalt getrunken. Gewiss zu sein scheint, dass gekühlte Getränke unseren Körper deutlich abkühlen. Glaubst du das auch? Das ist aber falsch. Es lässt sich nicht oft genug wiederholen: Nein, kalte Getränke kühlen nicht. Sie stellen eher eine Belastung für den Körper dar. Warum? Im Magen muss das kalte Getränk auf Körpertemperatur erwärmt werden. Dazu benötigt der Organismus Energie. Folglich produziert unser Körper zusätzliche Wärme – sicherlich der falsche Reiz bei warmem Wetter. Wir wissen: Das beste Mittel zur Temperaturregulierung ist das Schwitzen. Dabei entzieht das auf der Haut verdunstende Wasser dem Körper Energie in Form von Wärme - und der Mensch kühlt ab. Daher kommt auch immer wieder die Aufforderung, viel zu trinken, am besten mäßig gekühlte oder nicht zu warme Getränke. [1] Bild 2: Wirklich ärgerlich: Eine der beiden Colaflaschen haben wir neben die Kühlbox gelegt, nun ist sie schon sehr warm. Was passiert, wenn die aufgewärmte Flasche geöffnet wird?
Zurück zum Strandbad und zu einer zweiten verbreiteten Vorstellung. Da hat man sich also mit Broten, Sonnencreme und gekühlten Getränken versorgt – nach wie vor beliebt ist dabei eine kalte Cola. Nach Wasserschlacht, ernsten Gesprächen und Planungen für die nächsten Ferientage zieht man diese aus der Kühltasche, oder man stellt fest, dass die Flasche ohne Kühlelement bereits ordentlich aufgeheizt ist. Das wäre gar nicht so schlecht für die Kühlung des unserer Körper – siehe weiter oben -, ist aber sicherlich schlecht für den Geschmack und die Stimmung. Bild 3: Wird es stark schäumen, wenn man die warme Cola-Flasche öffnet?
Was hilft gegen diese verbreitete Meinung? Eine experimentell erworbene Erkenntnis. Führen wir das vergleichende Experiment, bei dem als abhängige Variabel die Temperatur verändert wird: Experiment 1: Kalte und heiße Colaflasche öffnen Material: Zwei Colaflaschen, die eine davon kühlschrankkalt (ca. 5° C), die zweite Flasche z.B. auf einer sonnigen Fensterbank erwärmt (ca. 40° C). Durchführung: Die kalte und die erwärmte Flasche werden gleichzeitig geöffnet. Beobachtungen: Die warme Flasche zischt beim Öffnen stärker. Beide Flüssigkeiten, die kalte und die erwärmte, schäumen etwa gleich stark. Bild 4: Die kalte (li.) und die erwärmte (re.) Colaflasche werden zum Vergleich gleichzeitig geöffnet
Ergebnis: Der Druck ist bei der erwärmten Flasche höher im Vergleich zur kalten CO2-haltigen Flüssigkeit. Die Schaumbildung durch die Freisetzung von Kohlenstoffdioxid ist in beiden Flaschen unabhängig von ihrer unterschiedlichen Temperatur ungefähr gleich groß.
mit freundlicher Unterstützung von Götz Godowski

(Foto: Lüttgens)
(Foto: Lüttgens)
Kann die heiße Colaflasche explodieren?
Auf die Frage, was denn nun passiert, wenn man eine deutlich erwärmte, mit einem kohlensäurehaltigen Getränk gefüllte Flasche öffnet, versichern nicht wenige Schülerinnen und Schüler glaubhaft von einem starken Schäumen und fast schon explosiven Bersten der Glasflasche.
(Foto: Lüttgens)

(Foto: Lüttgens)
Wir stellen fest, dass außer einem Zischen und ein wenig Schaumbildung nichts passiert. Warum eigentlich nicht?
Für Spezialisten
Den meisten Mineralwässern wird Kohlenstoff CO2 industriell beigemischt. Dabei wandelt sich das CO2 im Wasser in Kohlensäure H2CO3 um – so die die verbreitete Vorstellung bei vielen Menschen. Tatsächlich jedoch löst sich der größte Teil des Gases einfach in Wasser (1). Nur ca. 0,2 % des Kohlenstoffdioxids reagiert mit Wasser unter Bildung von Kohlensäure (2).
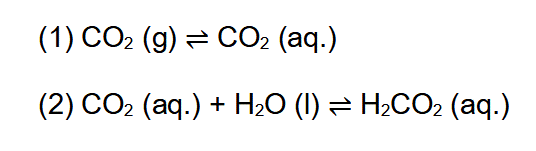
Somit ist die Bildung von Kohlensäure praktisch vernachlässigbar, auch wenn jeder bei Cola an ein coffein- und kohlensäurehaltiges Süßgetränk denkt (Siehe Tipp des Monats August 2012 (Tipp-Nr. 182)).
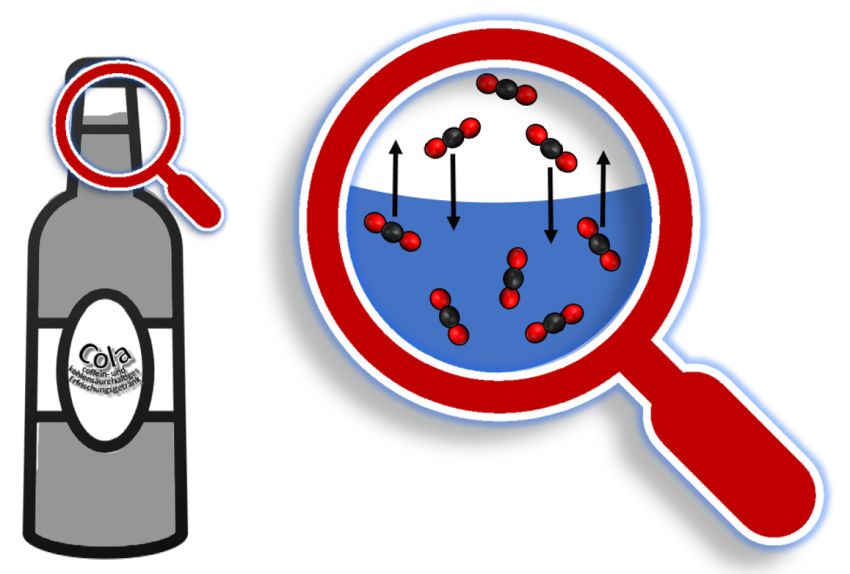
Skizze 1: Mit einer „chemischen Lupe“ können wir das dynamische Gleichgewicht der Teilchen zwischen der flüssigen und der gasförmigen Phase „sehen“: Dynamisch heißt: Ständig wechseln Kohlenstoffdioxidmoleküle an der Grenzfläche die Seite, ohne dass sich die Stoffkonzentrationen in beiden Phasen ändern.
(Skizze: Lüttgens)
Der Blick auf die erste Gleichung (1) zeigt, dass sich in der ungeöffneten Flasche ein Gleichgewicht einstellt zwischen gasförmigem und in Wasser gelöstem Kohlenstoffdioxid. In diesem thermodynamischen Gleichgewicht laufen das Lösen von CO2 – das ist die Hinreaktion – und die Freisetzung von gasförmigem CO2 als Rückreaktion gleich schnell ab.
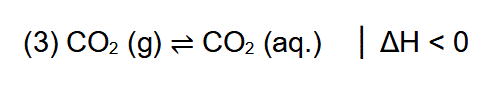
Störung des Gleichgewichts durch Temperaturänderung
Die Herstellung des sprudelnden Getränks ist ein exothermer Prozess, bei dem Energie frei wird (3). Deshalb ist die Enthalpieänderung δH kleiner Null, also negativ. Die Rückreaktion ist endotherm. Diese Information wird wichtig, wenn sich die Temperatur der Lösung ändert. Denn wir verändern so das Gleichgewicht des Lösens und des Freisetzens von Kohlenstoffdioxid in der Flasche – physikalische Chemikerinnen und Chemiker sprechen von der Störung des Gleichgewichts. Und wir stören es durch die Zufuhr von Energie durch die Änderung der Temperatur δT. Das Zischen der heißen Cola beim Öffnen zeigt uns, dass im Gasraum der Druck gestiegen sein muss. Der Druck ist deshalb gestiegen, weil CO2 aus der Lösung in den Gasraum gelangt ist. Diese Reaktion – man liest die Gleichung (3) einfach von rechts nach links, also rückwärts –, benötigt Energie. Diese Rückreaktion sorgt für den „Abtransport“ der durch die Temperaturerhöhung von außen zugeführten Energie. Genau genommen wird diese dazu verwendet, die zwischenmolekularen Wechselwirkungen zwischen den hydratisierten Kohlenstoffdioxid-Molekülen und den sie umgebenden Wassermolekülen aufzubrechen, wenn die Moleküle an der Grenzfläche von der flüssigen Phase in den Gasraum wechseln. Thermodynamisch geschulte Menschen würde es so formulieren:
Das dynamische Gleichgewicht des Lösens von gasförmigem Kohlenstoffdioxid und des Freisetzens von gelöstem Kohlenstoffdioxid reagiert auf die Störung durch eine Temperaturerhöhung, indem es diesen Zwang durch die endotherme Reaktion verkleinert. Dabei stellt sich ein neues Gleichgewicht ein.
Die Freisetzung von gasförmigem Kohlenstoffdioxid CO2 in der verschlossenen Flasche, die dort zu einem höheren Druck führt, wird beim Öffnen hörbar durch das Zischen.
Störung des Gleichgewichts durch Druckänderung
Da sich weniger Kohlenstoffdioxid in dem süßen, erwärmten Erfrischungsgetränk befinden, ist keine erhöhte Schaumbildung zu erwarten. Der Versuch bestätigt unsere Annahme. Wird die Flasche geöffnet, findet eine weitere Störung des Gleichgewichts statt. Diesmal sinkt im Gasraum schlagartig der Druck. Auf die Änderung des Drucks δT reagiert das das System aus Flüssigkeit und Gas durch weitere Freisetzung von Kohlenstoffdioxid in die gasförmige Phase, um der Druckänderung entgegenzuwirken. Da in der erwärmten Flüssigkeit die Konzentration an gelöstem Kohlenstoffdioxid bereits geringer ist als in der kalten, wie wir nun wissen, kann die Schaumbildung auch nicht besonders stark ausfallen. Da hilft nur viel Schütteln vor dem Öffnen des Deckels. Viel Spaß dabei...
Wer mehr über die Verschiebung von Gleichgewichten und das Prinzip von Le Chatelier wissen möchte, kann hier vorbeischauen oder im Chemiebuch nachlesen [2].
Zu guter Letzt
Pimboli, ein Kommentator zum oben erwähnten Tagesspiegel-Artikel [1], meint: „Der Beitrag basiert auf dem alten "modernen Mythos", dass heißer Tee bei Hitze am Besten ist, weil ja auch die Beduinen heißen Tee trinken. Dabei gibt es, wie jeder weiß, nur eine richtige Erfrischung bei großer Hitze: Ein eiskaltes Getränk. Oder noch besser: Einen Berg Eiskreme!“
Literatur:
[1] Thomas de Padova; Flüssigkeitsverlust: Warum warme Getränke bei Hitze helfen; Tagesspiegel 28.7.2010; https://www.tagesspiegel.de/wissen/warum-warme-getranke-bei-hitze-helfen-6749554.html (abgerufen am 3.6.2023)
[2] FOKUS Chemie SII; Cornelsen Verlag GmbH; Berlin 2018, S. 110 f.
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 6. Juli 2023, Fritz Franzke