Kein Gummi ohne Vulkanisation
Experimente:
Versuch: Herstellen von Gummi aus Latex
Was Naturkautschuk und Gummi unterscheidet
Die Makromoleküle des Kautschuks bestehen aus langen Ketten, die frei gegeneinander
verschiebbar sind. Somit ist Naturkautschuk ein typischer Thermoplast. Aufgrund der
Doppelbindungen und anderer Strukturmerkmale ist Kautschuk aber auch sehr klebrig.
Die dafür verantwortlichen Bindungen heißen van der Waals-Bindungen;
sie sind nicht besonders stabil und wirken nur zwischen unpolaren Substanzen. Das Kleben
erwies sich im Alltagsgebrauch als sehr störend. Die früher aus Naturkautschuk hergestellten
Regenmäntel waren entsprechend unangenehm zu tragen. Außerdem rochen sie schlecht und waren
sehr temperaturempfindlich, zum Beispiel wurden sie in der Kälte brüchig. Deshalb haben sich
schon bald viele Tüftler damit beschäftigt, den Kautschuk zu verbessern.
Hier half der Zufall weiter: Dem amerikanischen Chemiker Charles Nelson Goodyear (1800-1860) fiel 1844 eine Tüte mit Schwefelpulver in die heiße Latexbrühe. Beim weiteren Erhitzen auf der Herdplatte entstand eine trockene und dauerhaft elastische Substanz: Ein neuer Stoff, das Gummi, war erfunden. Goodyear gilt somit als Entdecker der Vulkanisation.
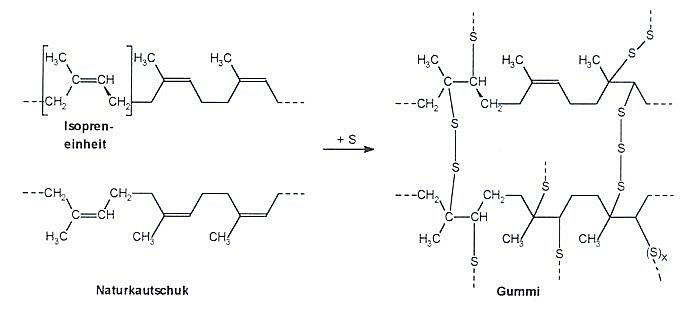
Damit haben wir das Verfahren eigentlich schon beschrieben. Beim Vulkanisieren
wird zum Latex Schwefel zugegeben; die Mischung wird erhitzt. Dabei werden die meisten Doppelbindungen
aufgebrochen; die langen Ketten der Makromoleküle werden untereinander über Schwefelbrücken
verbunden. Auf diese Weise wird der Thermoplast Kautschuk in das Elastomer Gummi überführt. In
dieser Form ist der Kunststoff auch nicht mehr klebrig.
Je mehr Schwefel im Gummi enthalten ist, desto härter wird es.

Die Struktur von Naturkautschuk (bzw. Latex) und Gummi im Vergleich
Die Vulkanisation im Experiment
Es reicht nicht aus, nur Schwefel zum Kautschuk oder zum Latex zuzugeben und zu erhitzen. Denn
die Reaktion ist nicht besonders schnell, weil es Mischungsprobleme gibt. Aus diesem Grund werden
Vulkanisationsbeschleuniger zugegeben: Zinkoxid ZnO und eine komplizierte Substanz namens
2-Mercaptobenzothiazol (abgekürzt MBT). Sie (und viele andere ähnliche Verbindungen) spielen letztlich
die Rolle von Katalysatoren.
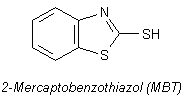
Das zuzusetzende Tensid hat die Aufgabe, zwischen dem nicht benetzbaren Schwefel und der polaren Lösung bzw. Emulsion des polaren Latex zu vermitteln. Man spricht hier von einem Phasentransfer-Katalysator.
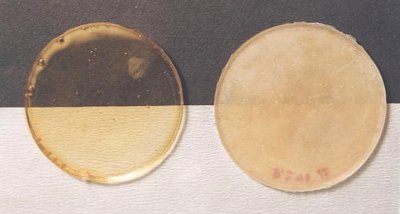
Getrockneter Latex (links) und selbsthergestelltes Gummi (rechts) im Vergleich
Übrigens ist Latex selbst eine Emulsion. Die Rolle der Emulgatoren übernehmen die Proteine.
Sie umhüllen die Makromoleküle des Naturkautschuks und halten sie so in "Lösung". So können sie
in der lebenden Pflanze leicht dahin transportiert werden, wo sie zum Wundverschluss benötigt
werden. Ein Vergleich mit der Milch von Säugetieren liegt nahe! Auch hier sind die unpolaren
Milchfettmoleküle von Proteinen umgeben.
Ein Blick in die Geschichte
Erfinder der Technologie um Latex waren lange vor Goodyear die Ureinwohner Amerikas, die Indianer
Mittelamerikas. Mayas, Azteken, Tolteken und Olmeken (um nur einige Völker zu nennen) kannten schon
die Klebewirkung von Latex (die uns so stört).
Außerdem ist allgemein bekannt, dass sie begeisterte Ballspieler waren. Der Vorteil ihres Ballspiels war (verglichen mit heute!) sicherlich der, dass die Mannschaft, welche ihr Spiel verlor, den Göttern geopfert wurde. Diesem Schicksal zu entgehen war sicherlich der Grund, weshalb die Indianer ausgefeilte Verfahren zur Herstellung von Gummi entwickelt haben. Sie kannten sogar schon die Vulkanisation! Dazu nahmen sie aber keinen Schwefel, sondern Pflanzen wie zum Beispiel die Mondblume (Impomoea alba), ein Windengewächs, das auch einen weißen Saft absondert. Der enthält nicht nur Terpene, sondern auch ausreichend Schwefelverbindungen.
Wenn die Indianer Spargel gehabt hätten, hätten sie wegen seines Schwefelgehalts sicherlich den genommen...
Quelle für Bilder und Experiment:
Karsten Bangemann: Staatsexamensarbeit Bielefeld 1997
Weitere Texte zum Thema „Auto“