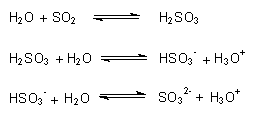
Chemische Eigenschaften und Toxizität von Schwefeldioxid
Experimente:
Versuch: Verbrennen von Schwefel
Versuch: Entwickeln von Schwefeldioxid aus Natriumdisulfit
Versuch: Bildung von schwefliger Säure
Versuch: Nachweis von Schwefeldioxid mit Iodpapier
Versuch: Addition von Hydrogensulfit an Aldehyde
Versuch: Bleichung von Farbstoffen
Versuch: Bleichung von Blütenfarbstoffen
Verbrennt man Schwefel, so entsteht ein farbloses Gas, das stechend riecht und
deutlich sauer schmeckt: Schwefeldioxid (-> Versuch).
In der Umwelt gibt es für das Gas weitere Quellen.
Es folgt eine Zusammenfassung der wichtigsten chemischen Eigenschaften, die für die Wirkung von Schwefeldioxid auf die Umwelt verantwortlich sind. Sie sind aber auch Grundlage für die Entfernung von Schwefeldioxid aus den Abgasen.
1 Schwefeldioxid ist ein Säureanhydrid
Mit Wasser reagiert Schwefeldioxid zu schwefliger Säure (-> Versuch),
die stufenweise dissoziiert:
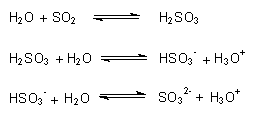
Mit schwefliger Säure bildet SO2 Additionsverbindungen. Deren Salze heißen Bi- oder Disulfite wie z. B. Na2S2O5. Aus ihnen stellt man das Gas am einfachsten und saubersten her (-> Versuch).
2 Schwefeldioxid ist ein Reduktionsmittel
Schwefeldioxid, schweflige Säure und ganz besonders deren Anionen sind durch
verschiedene Oxidationsmittel leicht oxidierbar. Sie sind also allesamt starke
Reduktionsmittel. Von technischer und ökologischer Bedeutung sind folgende
Reaktionen:
| - | Iod (hierauf beruht der SO2-Nachweis (->
Versuch));
SO2 + I2 + 2 H2O ———> SO42- + 2 I- + 4 H+ |
| - | Sauerstoff (Gipsbildung bei der
Rauchgasentschwefelung);
Ca2+ + 2 HSO3- + O2 ———> CaSO4 · aq + H2SO4 |
| - | Vanadiumpentoxid (V2O5) oder
Eisenoxid (Fe3O4) (Kontaktverfahren zur Herstellung
von Schwefelsäure);
|
| - | NOx (Historisches
Bleikammerverfahren zur Herstellung von Schwefelsäure)
|
| - | Hydroxylradikal HO· (Atmosphärische Bildung von
Schwefelsäure)
SO2 + 2 HO· ———> H2SO4 |
3 Schwefeldioxid addiert sich an Aldehyde
Mit Aldehyden, wie z. B. mit Acetaldehyd, reagiert Schwefeldioxid unter Bildung von
Additionsverbindungen (-> Versuch).
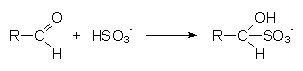
4 Schwefeldioxid bleicht Farbstoffe
Diese Wirkung auf Farbstoffe kann fast immer durch die Addition von Schwefeldioxid
bzw. Hydrogensulfit-Ionen an Doppelbindungen des ungesättigten Farbstoffmoleküls
erklärt werden. Hierauf beruht auch die Chemie der Tintenkiller.
Die Entfärbung ist manchmal durch Zugabe eines Oxidationsmittels oder durch Zugabe von
Aldehyden reversibel (Schiffscher Aldehydnachweis)
(-> Versuch).
Auf Addition von Hydrogensulfit-Ionen beruht auch die entfärbende Wirkung auf
Blüten- und Blattfarbstoffe wie z. B. die Anthocyane (-> Versuch).
Gleiches gilt auch für die Haltbarmachung von Trockenobst.
Toxische Wirkung von Schwefeldioxid
Viele chemische Eigenschaften dieses Gases lassen sich mit den schädigenden
Wirkungen auf Lebewesen korrelieren:
Der saure Charakter unter Einbeziehung der Eigenschaft als starkes
Reduktionsmittel führt wegen der Bildung von
Schwefelsäure zur Schädigung der Lungen bzw. bei Wassertieren des
Kiemengewebes.
Da Biochemie weitgehend Aldehydchemie ist, wirkt sich die Bildung von
Additionsverbindungen mit Aldehyden auf molekularbiologischer Ebene aus. Man
betrachte in diesem Zusammenhang z. B. die Glykolyse: So bildet Hefe in Gegenwart
von geringen Mengen an Hydrogensulfit-Ionen anstelle von Ethanol nur Glycerin, da die
Glykolyse auf der Ebene von Glycerinaldehyd unterbrochen wird (sog. Sulfitgärung).
Große Mengen an Schwefeldioxid töten Mikroorganismen ab (wie beim Schwefeln des
Weines oder von Weinfässern).
Weiterhin ist Schwefeldioxid ein Quellgas, das bei der Entstehung des Sauren Regens
eine wichtige Rolle spielt. Die hierbei gebildete Schwefelsäure greift Böden, Gebäude,
Pflanzen und Tiere an.
Weitere Texte zum Thema „Auto“