Prof. Blumes Tipp des Monats September 2003 (Tipp-Nr. 75)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Chemie des Tintenkillers
Viele Kinder benutzen bei den Schularbeiten Tintenkiller. Deshalb fragen sich auch die Eltern: Wie funktionieren sie und welche Stoffe sind darin enthalten? Können die nicht giftig sein?
Andererseits: Was wäre heute ein Schüler ohne Tintenkiller? Der verhilft zu sauberem Aussehen der abgegebenen Klassenarbeit und stimmt erfahrungsgemäß den korrigierenden Lehrer milder. Wir früher mussten dagegen entweder textlich Misslungenes durchstreichen (dann sah eine Klassenarbeit furchtbar aus) oder wir versuchten es mit harten Radiergummis. Das führte oft genug zur Durchlöcherung des Papiers. Ob Sie es glauben oder nicht: Früher gab es Lehrer, die das Radieren glatt untersagten. Man hatte stattdessen mit Lineal einen feinen Strich zu ziehen und das zu korrigierende Wort in Schönschrift (diesmal hoffentlich richtig) neu zu schreiben.
|
Versuch 1: Wirkungsweise eines Tintenkillers
|
Heute sind auch die zunächst verpönten Tintenkiller so akzeptiert, dass manche Lehrer dazu sogar Facharbeiten ausgeben: Wie funktioniert ein Tintenkiller? Vor allem: Was steckt chemisch dahinter?
Kann man die Wirkung der Tintenkiller auch im Reagenzglas zeigen? Dazu müssen wir erst einmal wissen, was darin enthalten ist, was die Bleichsubstanz ist.
Chemische Untersuchung eines Tintenkillers
Wir haben eine Reihe von Fabrikaten gekauft, und wir haben sie alle ausprobiert.
Zur Untersuchung öffnet man einen Tintenkiller. Der farblose Filz enthält die
Bleichlösung, der blaue die tintenkillerresistente Tinte zum Korrekturschreiben.
Dazwischen befindet sich ein farbloses Kunststoffstück, um die beiden Filze auseinander zu halten.
Alle Produkte zeigten alkalische Reaktion.
Als Bleichsubstanzen kommen Natriumsulfit Na2SO3 oder Natriumdithionit
Na2S2O4 in Frage. Aus vielerlei Gründen beschränken wir uns auf
das Natriumsulfit.
|
Versuch 2: Untersuchung der Bleichsubstanz eines Tintenkillers
|
HSO3- + H+ ———> H2O + SO2
|
Die Reaktion ist eine Nachweisreaktion für Sulfit.
HSO3- + H2O + I2 ———> HSO4- + 2 I- + 2 H+
|
Sie reagiert alkalisch. Die alkalische Reaktion beruht darauf, dass Natriumsulfit als Salz einer schwachen Säure mit Wasser eine Protolyse erleidet.
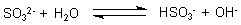
Es spricht also alles dafür, dass es sich bei dem Bleichmittel um Natriumsulfit-Lösung handelt.
(Dem Vernehmen nach hat man dem Tintenkiller zur Verstärkung der alkalischen Reaktion noch Soda hinzugefügt.)
Nun müssen wir erproben, ob auch das Natriumsulfit aus der Chemikaliensammlung mit Tinte reagiert.
|
Versuch 3: Entfärbung von Tinte mit Natriumsulfitlösung
|
Was der Tintenkiller beim Farbstoffmolekül bewirkt
Tinten beruhen auf organischen Farbstoffen. Hierbei handelt es sich vor allem um Triaryl-methan-Farbstoffe
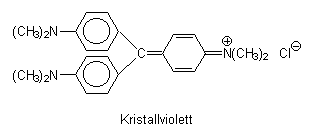
(auch Triphenyl-methan-Farbstoffe genannt). Bekannt für diese Reihe ist zum Beispiel das
Kristallviolett, das auch als Stempelfarbe dient.
Die Triaryl-methan-Farbstoffe (zu denen auch die Schulklassiker Phenolphthalein oder Fluorescein gehören) haben alle eine ähnliche Struktur. Vor allem gibt es ein zentrales, ungesättigtes C-Atom, an dem drei aromatische Reste hängen. Diese Konstellation ist für die Farbigkeit der Substanzen verantwortlich. Sie enthalten viele vagabundierende Elektronen, die sich über das ganze Farbstoffmolekül verteilen können. Sie sind bereits durch sichtbares Licht leicht anregbar, absorbieren deshalb aus dem einstrahlenden Licht bestimmte Wellenlängenbereiche (beim Kristallviolett zum Beispiel Gelbgrün) und geben die Komplementärfarbe unverändert zurück. Voraussetzung für die Beweglichkeit der Elektronen ist, dass das gesamte Molekül planar wie eine Scheibe ist.
Negativ geladene Teilchen (Anionen) wie das Hydroxid-Ion OH- oder das Hydrogensulfit-Ion HSO3- greifen am zentralen C-Atom an und werden addiert. Das zentrale C-Atom verliert so seinen ungesättigten Charakter. Das kann man besonders schön am Kristallviolett zeigen.
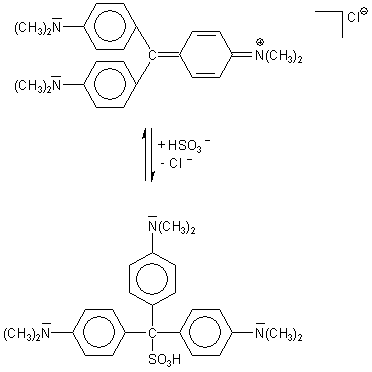
Durch die Addition des Anions wird die Geometrie des Farbstoffmoleküls total
verändert: Es verliert seine Planarität und nimmt die Form einer Pyramide an. (Für
Fachleute: Im Triaryl-methan-Farbstoffmolekül ist das zentrale Kohlenstoffatom
sp2-hybridisiert, im Additionsprodukt finden wir den sp3-Typ.)
Damit können sich die Elektronen nicht mehr über das ganze Molekül verteilen; das
sichtbare Licht kann nicht mehr mit ihnen in Wechselwirkung treten. Der Farbstoff absorbiert
statt sichtbaren Lichts nun nur noch UV-Strahlung. Folglich wird der Stoff für uns
farblos, er wird zum Leukofarbstoff.
Auf Grund ihrer negativen Ladung reagieren die Anionen vor allem mit solchen
Triaryl-methan-Farbstoffen, deren Moleküle wie beim Kristallviolett (abgekürzt KV)
positiv geladene Ionen sind.
KV+ + HSO3- ———> KV-SO3H
|
Versuch 4: Entfärben von Kristallviolettlösungen
|
Grund ist, dass Wasserstoffperoxid (H2O2) den Sulfitrest im Kristallviolett-Molekül zu Sulfat oxidiert, was zum Zerfall des Additionsprodukts führt. Das Rückfärben erreicht man auch durch Liegenlassen der Korrektur an der Luft, was mit der Beobachtung übereinstimmt, dass gekillte Schrift irgendwann wieder lesbar wird.
Man kann die Entfärbung auch durch Zusatz von Aldehyden wieder rückgängig machen.
|
Versuch 5: Rückfärben von Kristallviolett mit Acetaldehyd
|

(Foto: Daggi)
Darauf beruht ein klassischer Aldehydnachweis, bei dem allerdings mit Fuchsin
gearbeitet wird (-> Schiff-Reagenz). Grund für die
Rückfärbung ist, dass auch die Aldehyde mit Sulfit eine Additionsverbindung bilden,
zu deren Bildung sie das Sulfit-Ion dem Leukofarbstoffmolekül entreißen. Allerdings
wird nicht mehr die volle Farbtiefe erreicht, weil es sich um eine
Gleichgewichtsreaktion handelt.
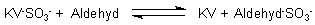
Das Rückfärben können wir auch mit der entfärbten, zuvor blauen Tinte zeigen.
|
Versuch 6: Rückfärben von gebleichter Tinte
Hinweis: Dieser Versuch funktioniert nicht mit allen Tintensorten! Deshalb müssen Sie den Versuch unbedingt vorher ausprobieren. |
Die Tintenkillerstifte sind, wenn man sie nicht gerade zum Mittagessen verspeist, gesundheitlich unbedenklich. Das gilt auch für das bisschen Alkohol, das man dem Tintenkiller zur Erhöhung seiner Wirksamkeit hinzugefügt hat.
Warum reagiert die Lehrertinte nicht mit Tintenkillern?
Das ist eigentlich genial und weise von der Natur eingerichtet. Die blaue Tinte der Schüler
lässt sich tilgen, die rote Kommentar- und Korrekturtinte der Lehrer dagegen nicht. Woran das liegt,
erfahren Sie auf einer besonderen Webseite.
Ökologische Tintenkiller
Ab und zu begegnen einem Tintenkiller, die als ökologisch unbedenklich gelten. So soll man statt
Natriumhydrogensulfit eine Lösung von Natriumhydrogencarbonat oder Natriumcarbonat nehmen. Beide
reagieren schwach alkalisch, denn sie bilden mit Wasser OH--Ionen (Stichwort "Protolyse").
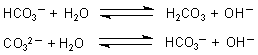
Diese Ionen addieren sich wie die Hydrogensulfit-Ionen am mittleren C-Atom des Farbstoffmoleküls. Die Folge: Der Farbstoff entfärbt sich. Probiert es mal aus!
Nur bildet sich bei Einwirkung von Luft die blaue Farbe leicht zurück. Der Grund ist, dass das darin enthaltene CO2 sich als Säureanhydrid mit Wasser zu Kohlensäure umsetzt. Dazu reichen auch die leichten Feuchtigkeitsspuren im Papier aus. Die Protonen der Kohlensäure entziehen dem Leukofarbstoff die OH--Ionen, und so kommt es zur Rückfärbung der Tinte.
Zum guten Schluss etwas Fächerübergreifendes
Der Tintenkiller wirft aus philosophischer Sicht ein Problem auf, auf das Mike Krüger in der
RTL-Sendung "7 Tage - 7 Köpfe" aufmerksam gemacht hat: Wo eigentlich bleibt das gelöschte Wort?
Wohin geht es? Was wird aus ihm?
Dank an Dr. Norbert Fischer von der Firma Pelikan!
Zur Chemie mit Wasserstoffperoxid haben wir eine große
Webseitengruppe.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 04. Januar 2011, Dagmar Wiechoczek