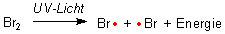
Halogenierung von Alkanen
Experimente:
Versuch: Fotohalogenierung von Heptan mit Brom
Alkane sind so reaktionsträge, dass selbst die reaktiven Halogene Fluor, Chlor und
Brom nur unter bestimmten Voraussetzungen mit ihnen reagieren.
Gibt man zu einer Probe eines flüssigen Alkans elementares Brom hinzu, geschieht erst einmal nichts. Erst wenn man diesen Ansatz mit einer starken Lichtquelle, wobei sich die Lampe eines Overheadprojektors anbietet, bestrahlt, ist eine Reaktion zu beobachten. Die typische braune Farbe des Broms verschwindet und gasförmiger Bromwasserstoff HBr entweicht in großen Mengen.
Wie ist diese Reaktion zu erklären?
Bei der Reaktion zwischen einem Alkan und Brom handelt es sich um eine Substitution.
Das bedeutet, dass ein Wasserstoffatom eines C-Atoms des Kohlenstoffgerüsts durch ein Bromatom ersetzt
wird.
Genau genommen handelt es sich um eine radikalische Substitution. Denn hieran sind Radikale beteiligt. Radikale (klicke hier und hier) sind hochreaktive Atome oder Verbindungen, die ein freies Elektron aufweisen. Ungepaarte Elektronen bedeuten in der Chemie immer sehr hohes Reaktionsvermögen.
Das Brommolekül wird zunächst durch Licht in zwei Bromatome gespalten:
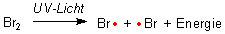
Diese Bromatome sind Radikale. Sie greifen jeweils an der C-H-Bindung des Alkans an und "ziehen" ein Wasserstoffatom vom Kohlenstoff ab. Es wird HBr gebildet, das sich als Säure mit Indikatorpapier nachweisen lässt.

Zurück bleibt ein neues Radikal - das Alkylradikal. Dieses ist der Rest des Alkans mit einem freien Elektron. In unserem Beispiel ist es das Ethyl-Radikal.
Auch dieses ist jetzt wiederum so reaktiv, dass es ein Bromatom vom Brommolekül angreifen kann.
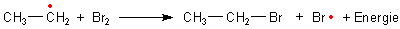
Es entstehen ein Bromalkan und ein neues Bromatom als Radikal. Die Bildung des Bromalkans ist in diesem Fall exotherm. Dieser Schritt liefert die gesamte Triebkraft der Reaktion.
Die Fotohalogenierung ist eine Kettenreaktion
Das neue Radikal greift wieder ein neues Alkanmolekül an, und die Reaktion beginnt von vorne.
Es wird also eine Kettenreaktion gestartet:
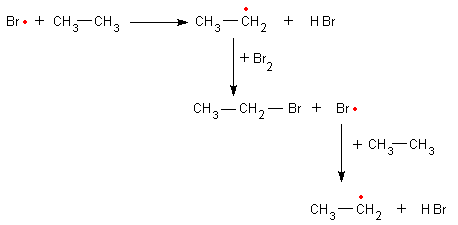
Diese wird erst unterbrochen, wenn zwei der Radikale aufeinandertreffen.
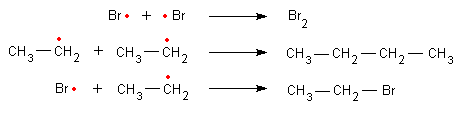
Da im Reaktionsverlauf die Konzentration der freien Radikale gering bleibt, ist es relativ unwahrscheinlich, dass zwei Radikale zusammentreffen und es so zu einem Kettenabbruch kommt.
Die Substitution durch andere Halogene
Chlor reagiert viel heftiger als Brom. Zwischen Chlor und Methan ist die Reaktion
sogar so heftig, dass die Mischung bei Belichtung explodiert. Es bildet sich dabei ein Gemisch aller
Chlormethan-Derivate - bis zum CCl4.
Iod dagegen reagiert gar nicht - es muss deshalb durch Austausch gegen einen anderen Substituenten eingeführt werden. Das geschieht zum Beispiel mit Alkoholen und Phosphortriiodid.
3 C2H5-OH + PI3 ———> 3 C2H5-I + H3PO3
Die Substitution mit Fluor ist problematisch
Die Fluorierung ist sogar so exotherm, dass sie zur Spaltung der C-C-Bindung führt!
Das heißt, dass in der C-C-Bindung ein C-Atom gegen ein Fluoratom ausgetauscht wird. Formal können wir das
so schreiben:
CH3-CH3 + F2 ———> CH3F + FCH3 + Energie
Die Bindung zu einem Fluoratom ist die stärkste Einfachbindung, die ein Kohlenstoffatom eingehen kann. Fluor ist schließlich das elektronegativste Element überhaupt.
Deshalb können die FCKWs (Fluorchlorkohlenwasserstoffe) nicht durch eine Fluorierung von Alkanen dargestellt werden.
Man geht deshalb so vor: Zunächst stellt man die entsprechenden Chloralkane her. Die lässt man anschließend mit Fluorwasserstoff reagieren. Dazu ist ein Katalysator notwendig: Aluminiumfluorid. Hier ist die Synthese des Frigens F-11.
CCl4 + HF ———> CCl3F + HCl
Andererseits hat die große Energiefreisetzung bei der Bindung zwischen C und F auch eine besonders hohe Stabilität der Fluoralkane zur Folge. So ist die C-F-Bindung gegen UV-Strahlung stabil, nicht aber die C-Cl-Bindung. Das spielt bei der Ausbildung des "Ozonlochs" eine Rolle.
Weitere Texte zum Thema „Kohlenwasserstoffe“