Für Experten
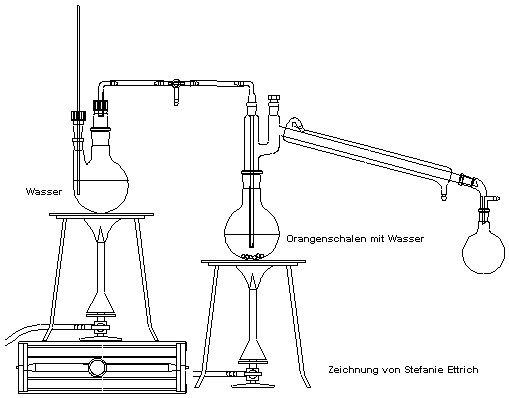
Die Wasserdampfdestillation
Experimente:
Versuch: Isolierung von Limonen aus Citrusfruchtschalen
(Demonstrationsversuch)
Versuch: Gewinnung von Zitronenschalenöl durch Wasserdampfdestillation
(Schülerversuch)

p = xA PA + xB PB
Dagegen sind Zitronenschalenöl und Wasser nicht miteinander mischbar. Folglich beeinflussen sich ihre Dampfdrücke nicht. Das bedeutet, dass der Dampfdruck nicht vom Mengenverhältnis der Mischungskomponenten abhängt. Der Dampfdruck der Mischung ist deshalb gleich der Summe der Dampfdrücke der reinen Komponenten bei der jeweiligen Temperatur.
p = PA + PB
Erhitzt man die Mischung, so siedet das Wasser bei 100 °C konstant weg und reißt dabei Zitronenschalenöl
mit (-> Versuch). Da der Dampfdruck der meisten Komponenten des Zitronenschalenöls
bei 100 °C recht gering ist, weil ihre Siedetemperatur viel höher liegt, muss allerdings auch viel
Wasser verdampfen, um alles Öl abzutrennen. Aus diesem Grunde muss man Wasser zugeben. Am besten
leitet man von vornherein heißen Wasserdampf durch die zu destillierende Mischung (->
Versuch). Dadurch unterstützt man den Destillationsvorgang.
Auf diese Weise können auch Stoffe, deren Siedepunkt weit über 100 °C liegt, schonend destilliert werden.
Noch ein Hinweis: Bei dem Verfahren handelt es sich genau genommen nicht um eine Destillation, sondern um eine Heißdampf-Extraktion.
Weitere Texte zum Thema „Zitrone“