Leitfähigkeitstitrationen (Konduktometrie)
Experimente
Versuch: Vergleich der Leitfähigkeit einiger Lösungen
Versuch: Volumetrische Leitfähigkeitstitrationen mit einfachem Messgerät
Wenn man eine Säure bei einer Leitfähigkeitstitration mit einer Lauge
versetzt, verändert sich bis zur Neutralisation die Leitfähigkeit der Lösung. Wir wollen das hier genauer
erklären. Dazu müssen wir starke und schwache Elektrolyte unterscheiden.
Zuvor noch etwas zum Messverfahren
Man spricht bei der Leitfähigkeitstitration auch von Konduktometrie (lat. conductor; der
Zusammenführende, der Leitende).
Leitfähigkeitsmessungen erfolgen grundsätzlich mit Wechselstrom, um die Elektrolyse der Lösungen
auszuschließen. Je höher die Konzentration ist, desto höher sollte die Stromfrequenz liegen. Für unsere
Zwecke reicht aber der 50 Hz-Wechselstrom aus der Steckdose aus. Aber bitte ja nicht bei 230 V arbeiten!
Da ist die Knallgasexplosion vorprogrammiert. Spannungen um 1 Volt reichen völlig aus.
Da durch Zugabe der Titrierlösung die Lösung insgesamt verdünnt wird und damit die Leitfähigkeit
während der Titration schon deswegen abnimmt, schränkt man diesen Fehler ein, indem man die Titrierlösung
möglichst konzentriert einstellt.
Konduktometrische Titration von starken Elektrolyten
Wir nehmen als Beispiel die starken Elektrolyte Salzsäure und Natronlauge. Die Reaktionsgleichung ist
in Ionenschreibweise:
H+ + Cl- + Na+ + OH- ———> H2O + Na+ + Cl-
Wir sehen, dass bei der eigentlichen Neutralisationsreaktion die elektrisch leitenden H+- und die OH--Ionen verschwinden und ein nicht leitendes Wassermolekül bilden.
H+ + OH- ———> H2O
Andererseits tauschen wir während der Titration doch jeweils
- ein H+-Ion gegen ein Na+-Ion
- ein OH--Ion gegen ein Cl--Ion
aus. Da sollte sich doch gar nichts ändern.
Betrachten wir einmal die Leitfähigkeiten der einzelnen Ionen (-> Versuch) (hier bei 25 °C). Hierzu teilt man die Leitwerte (also die reziproken Widerstände) durch die jeweiligen Konzentrationen und extrapoliert sie auf "unendliche Verdünnung". Die Werte findet man als "Äquivalentleitfähigkeiten" in Tabellenwerken aufgelistet. Die Dimension ist [ohm-1 · cm2 / mol]. Für [ohm-1] schreibt man auch Ohm rückwärts: [mho]. Das Symbol steht für "reziproke Ohm".
| H+ | 350 |
| Cl- | 76 |
| Na+ | 51 |
| OH- | 192 |
Wie ermittelt man eigentlich diese Einzelleitfähigkeiten? Durch geeignete Messanordnung und chemische Analytik gelingt es, bei Elektrolysen den Anteil der einzelnen Ionen am Ladungstransport zu ermitteln. Aus den so erhaltenen "Überführungszahlen" lassen sich die Einzelleitfähigkeiten berechnen.
Aus den Einzelleitfähigkeiten wiederum kann man auch die Leitfähigkeiten der Elektrolyt-Lösungen durch einfache Addition berechnen.
| HCl | 426 |
| NaOH | 243 |
| NaCl | 127 |
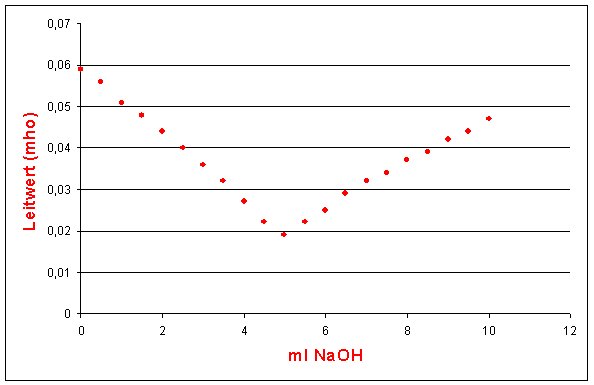
Wenn wir also eine Säure vorlegen, sinkt die Leitfähigkeit ab. Beim Äquivalenzpunkt erreicht sie ihr Minimum. Bei Zugabe von überschüssiger Natronlauge steigt sie wieder an - allerdings nicht so steil, wie die Kurve zunächst abfiel. Da die Leitfähigkeiten proportional zur Konzentration der Ionen sind, erhalten wir zwei Linien, die sich im Äquivalenzpunkt schneiden. Idealerweise sind das bei starken Elektrolyten zwei Geraden. Damit kann diese Titration wie eine normale volumetrische Titration (Maßanalyse) ausgewertet werden.

Bild 1: Leitfähigkeitstitration (Vorlage 50 ml HCl (c = 0,1 mol/l); Titriermittel NaOH (c = 1 mol/l));
(-> Versuch)
Dieses Bild können wir auch aus den Äquivalenzleitfähigkeiten der einzelnen Ionen konstruieren. Dazu zeichnen
wir für jede Ionenart den Verlauf ihres Beitrags zur Gesamtleitfähigkeit ein. Wir erhalten somit vier Geraden.
Anschließend werden für jeden ml-Wert die Ordinatenabschnitte addiert. Daraus ergibt sich der bekannte Verlauf
der beiden Äste der Titrationskurve.
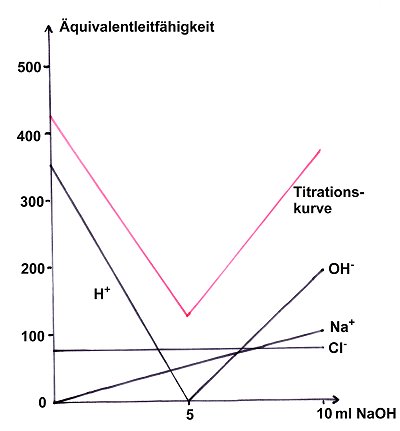
Bild 2: Konstruktion der Geraden der Leitfähigkeitstitration von HCl mit NaOH aus dem Verlauf der
Leitfähigkeiten der einzelnen Ionen. Aus Gründen der Vereinfachung wurde auf die Einrechnung der Verdünnung verzichtet
Können wir dieses unterschiedliche Wanderungsverhalten der Ionen erklären?
Protonen wandern in wässriger Lösung, indem sie durch einfaches, großräumiges Umklappen der
Wasserstoffbrückenbindungen weitergereicht werden. Entgegengesetzt (aber langsamer) wandern in
den Wasseraggregaten die negativen Ladungen der OH--Ionen. Lies dazu unsere
Webseite.
Anders ist es bei den "echten" Ionen, also Na+ und Cl-. Die müssen sich - gezogen
vom elektrischen Feld - regelrecht gegen die Wassermoleküle durch das Wasser mühen. Erschwerend tritt noch
hinzu, dass diese Ionen mit einer fest haftenden Hydrathülle umgeben
sind, die sie mitschleppen müssen.
Konduktometrische Titration von schwachen Elektrolyten
Wir wählen als Titrationsbeispiel die Essigsäure, die wir mit der starken Natronlauge titrieren.
Das folgende Bild zeigt das Ergebnis:
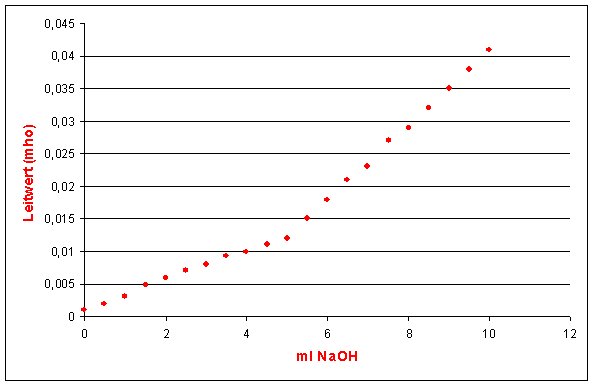
Bild 3: Leitfähigkeitstitration (Vorlage 50 ml Essigsäure (c = 0,1 mol/l); Titriermittel NaOH (c = 1 mol/l));
(-> Versuch)
Das Ergebnis kann wie folgt gedeutet werden: Die schwache Essigsäure liegt bei einer Konzentration von
0,1 mol/l nur zu etwa einem Tausendstel dissoziiert vor. Aus diesem Grunde reagiert die Natronlauge nicht
mit den Protonen, sondern direkt mit der Säure.
CH3COOH + Na+ + OH- ———> H2O + CH3COO- + Na+
Die Startleitfähigkeit ist deshalb äußerst gering (vergleiche die Bilder 1 und 3!). Mit steigender
Zugabe an Natronlauge steigt auch die Leitfähigkeit - zunächst nur langsam, da OH--Ionen
gegen weniger gut leitende Acetat-Ionen ausgetauscht werden. Man muss bedenken, dass ja auch noch
ständig Na+-Ionen hinzukommen.
Nach Verbrauch der Essigsäure steigt die Kurve steiler an, da jetzt auch die OH--Ionen
erhalten bleiben und zur Leitfähigkeit beitragen.
Es resultieren zwei Kurvenäste, deren gerade Anteile zu Beginn und Ende man extrapoliert. Beim
Schnittpunkt liegt der Äquivalenzpunkt.
Hier sind noch die Einzelleitfähigkeiten des Essigsäure-Systems bei angenommener vollständiger Dissoziation, extrapoliert auf eine einmolare Lösung in "unendlicher Verdünnung":
| Acetat-Ion | 41 |
| Essigsäure | 391 |
Weitere Texte zum Thema „Elektrochemie“